
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ. Комплексные соединения - это вещества, содержащие «центральный атом» – комплексообразователь, с которым в неионогенной связи находится определенное количество
Комплексные соединения - это вещества, содержащие «центральный атом» – комплексообразователь, с которым в неионогенной связи находится определенное количество атомов, ионов или молекул, составляющих внутреннюю сферу.
При написании формул таких соединений комплексные ион или молекулы заключают в квадратные скобки, а справа вверху (для ионов) указывают их заряд (например, [Ag(NH3)2]+). Часть комплексного соединения, заключенная в квадратные скобки, называется внутренней сферой. Ионы, находящиеся снаружи, образуют его внешнюю сферу.
Центральный ион внутренней сферы, удерживающий около себя определенное число других ионов или молекул, называется комплексообразователем. С комплексообразователем связаны (координированы) полярные молекулы или ионы, которые называются лигандами (или аддендами).
Способность к образованию комплексных соединений связана с электронным строением атомов. Особенно легко образуют комплексные ионы элементы d-семейства, например: Ag+, Au3+, Cu2+, Hg2+, Zn2+, Fe2+, Cd2+ и др. Однако роль комплексообразователей могут играть и некоторые неметаллы, например кремний в комплексной соли K2[SiF6].
В качестве лигандов (аддендов) выступает целый ряд отрицательно заряженных ионов, например F-, OH-, NO 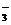 , CO
, CO  и др. Лигандами могут служить и электронейтральные полярные молекулы, такие как NH3, Н2О, РН3, СО и т. п.
и др. Лигандами могут служить и электронейтральные полярные молекулы, такие как NH3, Н2О, РН3, СО и т. п.
Количество химических связей между комплексообразователем и лигандами определяет координационное число комплексообразователя. Координационное число зависит в основном от природы комплексообразователя и лигандов, а также от условий образования комплексного соединения.
При составлении названия комплексного соединения используются следующие правила:
1) если соединение состоит из комплексного иона и ионов внешней сферы, т. е. является комплексной солью, то первым называется анион в именительном падеже, а затем катион в родительном падеже;
2) при названии комплексного иона сначала указываются лиганды, затем комплексообразователь;
3) молекулярные лиганды соответствуют названиям молекул (кроме воды и аммиака), для их обозначения применяются термины «аква» и «аммин».
К анионным лигандам добавляют окончание "о", например:
F- – фторо. O  – оксо, CNS- – родано, Cl- – хлоро, NO
– оксо, CNS- – родано, Cl- – хлоро, NO 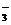 – нитрато, ОН- – гидроксо, Вг- – бромо, CN- – циано, SO
– нитрато, ОН- – гидроксо, Вг- – бромо, CN- – циано, SO  – сульфато, S2O
– сульфато, S2O  – тиосульфато, CO
– тиосульфато, CO  – карбонато, PO
– карбонато, PO  – фосфато, NO
– фосфато, NO  – нитро.
– нитро.
Для обозначения количества лигандов используются греческие числительные: 2 – ди-, 3 – три-, 4 – тетра-, 5 – пента-, 6- гекса-.
4) если комплексный ион – катион, то для названия комплексообразователя используют русское наименование элемента, если анион, то латинское. После названия комплексообразователя римской цифрой в круглых скобках указывают его степень окисления. У нейтральных комплексов название центрального атома дается в именительном падеже, а его степень окисления не указывается.
Например:
[Ag(NH3)2]Cl – хлорид диамминсеребра;
K2[PtCl6] – гексахлороплатинат (IV) калия;
[Ni(NH3)6][Co(NO2)6] – гексанитрокобальтат (III) гексаамминникеля (III).
Необходимо обратить внимание, что формула комплексного соединения читается в обратной последовательности ее записи.
В водном растворе комплексные соединения диссоциируют по типу диссоциации сильного электролита – на комплексный ион и ионы, составляющие внешнюю сферу, например:
Na3[Co(NO2)6]  3Na++[Co(NO2)6]3–.
3Na++[Co(NO2)6]3–.
Внутренняя сфера типичных комплексных соединений в растворах может диссоциировать на ионы или на ионы и молекулы (по типу диссоциации слабого электролита). Например, ион
[Co(NO2)6]3-  Co3+ + 6NO
Co3+ + 6NO  .
.
Электролитическая диссоциация комплексных ионов подчиняется закону действующих масс и количественно характеризуется константой диссоциации, которая носит название константы нестойкости Кн:
 .
.
У типичных комплексных ионов Кн очень мала и является мерой его устойчивости.
Пример 1. Определите заряд комплексного иона, координационное число (к.ч.) и степень окисления комплексообразователя в соединениях: а) К4[Fe(CN)6]; б) Nа[Ag(NO2)2]; в) К2[МoF8];
г) [Cr(H2O)2(NH3)3Cl]Cl2.
Решение.
Заряд комплексного иона равен заряду внешней сферы, но противоположен ему по знаку. Координационное число комплексообразователя равно числу лигандов, координированных вокруг него. Степень окисления комплексообразователя определяется так же, как степень окисления атома в любом соединении, исходя из того, что сумма степеней окисления всех атомов в молекуле равна нулю. Заряды нейтральных молекул (Н2О, NH3) равны нулю. Заряды кислотных остатков определяют из формул соответствующих кислот. Отсюда:
| Заряд иона | К.ч. | Степень окисления | |
| а | -4 | +2 | |
| б | -1 | +1 | |
| в | -2 | +6 | |
| г | +2 | +3 |
Пример 2. Напишите выражение для константы нестойкости комплекса [Fe(CN)6]4-.
Решение.
Если комплексная соль гексацианоферрат (II) калия, являясь сильным электролитом, в водном растворе необратимо диссоциирует на ионы внешней и внутренней сфер: K4[Fe(CN)6] → 4K+ +[Fe(CN)6]4-, то комплексный ион диссоциирует обратимо и в незначительной степени на составляющие его частицы: [Fe(CN)6]4- ↔ Fe2+ + 6CN-.
Обратимый процесс характеризуется своей константой равновесия, которая в данном случае называется константой нестойкости (Кн.) комплекса. Чем меньше значение Кн, тем более прочен данный комплекс. Выражение константы нестойкости будет иметь вид

Не нашли, что искали? Воспользуйтесь поиском: