
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Теоретические пояснения
Подавляющее большинство электролитов обладает ограниченной растворимостью в воде. На практике часто встречаются гетерогенные системы, в которых осадок малорастворимого электролита находится в равновесии с насыщенным раствором этого электролита:

 (8.1)
(8.1)
осадок кристаллизация раствор
При насыщении раствора скорости процессов растворения и кристаллизации одинаковы, а концентрации ионов над твердой фазой электролита являются равновесными при данной температуре.
Константа равновесия гетерогенного процесса определяется только произведением активностей ионов в растворе и не зависит от активности твердого компонента:
 (8.2), (8.3)
(8.2), (8.3)
Таким образом, "произведение активностей ионов в насыщенном растворе малорастворимого электролита при заданной температуре есть величина постоянная, ее называют произведением растворимости и обозначают ПР.
Произведение растворимости как константа равновесия зависит от природы электролита и от температуры, но не зависит от активности ионов в растворе.
Зная, что ПP — величина постоянная при Т = const, можно сказать, что при увеличении концентрации одного из ионов в насыщенном растворе над твердой фазой концентрация другого иона уменьшается.
По известному произведению растворимости электролита 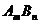 и активности одного из ионов (аA или аB) можно рассчитать активность другого иона, необходимую для осаждения электролита
и активности одного из ионов (аA или аB) можно рассчитать активность другого иона, необходимую для осаждения электролита 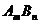 . Математическим условием образования осадка в этом случае является выражение:
. Математическим условием образования осадка в этом случае является выражение:
 (8.4)
(8.4)
8.2 Методика проведения опытов
8.2.1 Опыт 1 Условие образования осадков малорастворимых электролитов
В две конические пробирки внесите по 3-5 капель раствора сульфата железа (П); С=0,25 моль/л. В первую пробирку добавьте столько же капель сероводородной воды, а во вторую — раствора сульфида аммония (сделайте это при включенной тяге). Опишите свои наблюдения. При оформлении результатов опыта ответьте на вопросы:
1. В каком случае образовался осадок малорастворимого электролита? Запишите уравнение реакции в молекулярной и ионной форме.
2. При каком условии (а или б) образуется осадок FeS:
a) 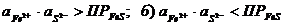
3. Зная ПРFeS и CFe2+, найдите CS2-, необходимую для осаждения сульфида железа.
8.2.2 Опыт 2 Полнота осаждения иона
В коническую пробирку внесите 4 капли раствора нитрата свинца (С= 0,25 моль/л) и добавьте к нему 6 капель раствора хлорида натрия (С=0,5 моль/л). Отцентрифугируйте осадок. Отберите пипеткой жидкую фазу и перенесите ее в две пробирки по 2-3 капли в каждую. В одну из пробирок добавьте 2-3 капли раствора хлорида натрия (С= 0,5 моль/л), а в другую — иодида калия (С = 0,5 моль/л). Опишите свои наблюдения. При оформлении результатов опыта ответьте на вопросы:
1. Какая реакция идёт в пробирке с нитратом свинца при добавлении хлорида натрия? Составьте молекулярное и ионное уравнения реакции. Укажите признак реакции.
2. В каком из двух случаев после центрифугирования вновь образуется осадок? Составьте ионное уравнение реакции образования осадка. Укажите признак реакции.
3. На основании опыта сделайте вывод о сравнительной величине произведения растворимости хлорида и иодида свинца. Приведите табличные данные и проверьте по ним свое заключение.
8.2.3 Опыт 3 Условие растворения осадков малорастворимых, электролитов
Приготовьте две конические пробирки. Внесите в одну из них 2 капли раствора сульфата железа (П), С = 0,25 моль/л; а в другую - 2 капли раствора сульфата меди (П), С = 0,25 моль/л, В каждую пробирку добавьте по две капли раствора сульфида аммония (сделайте это при включенной тяге). Отметьте появление осадков. К осадкам сульфидов железа и меди добавьте по 5-7 капель соляной кислоты (2н). Наблюдения опишите. При оформлении результатов опыта запишите:
1. Ионные уравнения реакций получения сульфидов железа и меди.
2.Уравнение реакции растворения осадка (молекулярное и ионное). В какой пробирке осадок не растворился?
3. При каком условии (а или б) растворяется осадок малорастворимого сульфида:
а) 
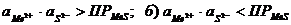
4. Пользуясь приведенными выше соотношениями (а и б) и табличными значениями ПРМеS, объясните, почему один из сульфидов растворился в соляной кислоте, а другой — нет?
8.2.4 Опыт 4 Определение произведения растворимости сульфата кальция
На аналитических весах взвесьте фарфоровую чашку объемом 20-30 мл, прилейте в нее из бюретки 10 мл насыщенного раствора сульфата кальция и поставьте чашку с раствором на разогретую электрическую плитку. Когда вся вода испарится и на стенках чашки появится белый налет гипса, с помощью металлических щипцов перенесите чашку в эксикатор, заполненный осушителем. Спустя 20-30 минут взвесьте чашку и вычитанием из результата взвешивания массы пустой чашки определите массу выделившейся соли.
Определите произведение растворимости сульфата кальция, считая, что осадок соответствует формуле CaSO4 • 0,5Н2О.
Пользуясь табличными данными, определите ошибку измерения в процентах. Ошибка порядка 20% считается приемлемой.
Не нашли, что искали? Воспользуйтесь поиском: