
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Изотермический процесс
При изотермическом процессе температура рабочего тела постоянна 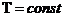 и, следовательно,
и, следовательно,

или
 (6.30)
(6.30)
то есть давление и объём при изотермическом процессе обратно пропорциональны друг другу. В связи с этим, при изотермическом процессе при сжатии (уменьшении объёма) давление газа возрастает, а при расширении (увеличении объёма) давление газа падает. Это положение известно как закон Бойля – Мариотта для газов. Роберт Бойль – английский естествоиспытатель, открывший ряд законов газа. Эдмом Мариотт – французский физик. Закон был открыт этими учёными независимо друг от друга.
Графиком изотермического процесса на  - диаграмме является равнобокая гипербола, для которой координатные оси диаграммы служат асимптотами. Рис. 6.6
- диаграмме является равнобокая гипербола, для которой координатные оси диаграммы служат асимптотами. Рис. 6.6

Рис. 6.6.  - диаграмма изотермического процесса
- диаграмма изотермического процесса
Работа при изотермическом процессе выражается формулой
 (6.31)
(6.31)
Так как температура не меняется, то внутренняя энергия идеального газа в данном процессе остаётся постоянной 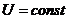 ,
,  и из уравнения первого закона термодинамики
и из уравнения первого закона термодинамики

следует, что
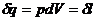 .
.
То есть при изотермическом процессе вся подводимая к газу теплота полностью переходит в работу расширения, а при изотермическом сжатии от газа отводится теплота в количестве, равном затраченной на сжатие работе.
 . (6.32)
. (6.32)

Адиабатный процесс
Процесс, происходящий без теплообмена с окружающей средой, называется адиабатным, то есть 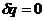 . Для осуществления процесса следует теплоизолировать рабочее тело, то есть поместить его в, так называемую, адиабатическую оболочку. Материал такой оболочки не проводит тепло. С другой стороны можно провести процесс настолько быстро, чтобы изменение температуры рабочего тела, обусловленное его теплообменом с окружающей средой, было пренебрежимо мало по сравнению с изменением температуры, вызванным расширением или сжатием газа. Как правило, это возможно, ибо теплообмен происходит значительно медленнее, чем сжатие или расширение газа.
. Для осуществления процесса следует теплоизолировать рабочее тело, то есть поместить его в, так называемую, адиабатическую оболочку. Материал такой оболочки не проводит тепло. С другой стороны можно провести процесс настолько быстро, чтобы изменение температуры рабочего тела, обусловленное его теплообменом с окружающей средой, было пренебрежимо мало по сравнению с изменением температуры, вызванным расширением или сжатием газа. Как правило, это возможно, ибо теплообмен происходит значительно медленнее, чем сжатие или расширение газа.
Запишем обе математических формулировки первого закона термодинамики


Как показано выше, в случае идеального газа для любого процесса, независимо от того, является ли объём или давление постоянным справедливо
 ,
,
 .
.
Тогда для адиабатного процесса, при 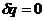 уравнения первого закона термодинамики принимают вид
уравнения первого закона термодинамики принимают вид
 (6.34)
(6.34)
 (6.35)
(6.35)
Поделим первое уравнение на второе, получим

или

Проинтегрируем последнее уравнение при условии, что  ,
,

находим
 .
.
После потенцирования имеем
 или
или  (6.36)
(6.36)
Из соотношения (6.36) следует, что для адиабатного процесса справедливо соотношение
 (6.37)
(6.37)
Уравнение (6.37) есть уравнение адиабаты идеального газа при постоянном отношении теплоёмкостей (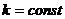 ). Величина
). Величина  - показатель в уравнении (6.37), представляющий собой отношение теплоёмкости газа при постоянном давлении к теплоёмкости газа при постоянном объёме
- показатель в уравнении (6.37), представляющий собой отношение теплоёмкости газа при постоянном давлении к теплоёмкости газа при постоянном объёме  , называется показатель адиабаты.
, называется показатель адиабаты.
Для одноатомного газа величина 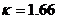 , для двухатомного
, для двухатомного  , для трёхатомного и многоатомных газов
, для трёхатомного и многоатомных газов  .
.
 (6.38)
(6.38)
 (6.39).
(6.39).
 (6.41)
(6.41)
Соотношения (6.38) – (6.41) дают связь между параметрами идеального газа в адиабатическом процессе.
Из уравнения первого закона термодинамики
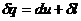
следует, что в адиабатическом процессе, так как теплообмен отсутствует, то есть 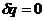 , то
, то

или для конечного изменения имеем
 . (6.42)
. (6.42)
Таким образом, работа в адиабатном процессе совершается за счёт убыли внутренней энергии.
Как установлено выше, изменение внутренней энергии для всех процессов, в том числе и для адиабатного, вычисляется по формуле
 (6.46)
(6.46)
 (6.47)
(6.47)
 (6.48)
(6.48)
Не нашли, что искали? Воспользуйтесь поиском: