
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Ток в электролитах.
Чистые соли, кислоты, щелочи не проводят электрический ток. При растворении электролитов под влиянием электрического поля полярных молекул воды происходит распад молекул электролитов на ионы. Этот процесс наз-ся электролитической диссоциацией.
Степень диссоциации зависит от температуры, концентрации раствора и диэлектрической проницаемости растворителя.Перенос заряда в водных растворах или расплавах электролитов осуществляется ионами, такую проводимость называют ионной.Ионы разных знаков при встрече могут снова объединиться в нейтральные молекулы - рекомбинировать. В электролитах (растворы солей, кислот, щелочей и расплавы солей) имеются положительные и отрицательные ионы. В растворе устанавливается динамическое равновесие между процессами диссоциации и рекомбинации ионов. Под действием электрического поля ионы приобретают направленное движение – положительные ионы (катионы) движутся к катоду, отрицательные (анионы) – к аноду. На аноде отрицательно заряженные ионы отдают свои лишние электроны, а на катоде положительные ионы получают недостающие электроны (восстановительная реакция). Процесс выделения на электроде вещества, связанный с окислительно-восстановитель-ными реакциями, называют электролизом. При электролизе в растворах солей масса катода увеличивается, так как на катоде осаждаются положительные ионы. Например, если электролитом является раствор медного купороса и мы берем медные электроды, то масса катода увеличивается со временем.
Для электролиза справедливы два закона Фарадея:
- Масса вещества, выделившегося при электролизе, прямо пропорциональна протекшему через электролит количеству электричества (заряду):
m = kq=kIt,
где k – электрический эквивалент данного вещества. Физический смысл электрического эквивалента состоит в следующем: k численно равен количеству вещества, выделившемуся при прохождении через электролит заряда 1 Кл(СИ),[k] = кг/ Кл
- Закон Фарадея устанавливается связь между электрохимическим и химическим эквивалентами данного вещества:
k = x /F
где x – химический эквивалент вещества, равный отношению атомной массы вещества А к его валентности n: x =A/n, F- постоянная Фарадея, не зависящая от свойств электролита, F= 9,65*10  Кл/моль. Подставим получим объединенный закон Фарадея.
Кл/моль. Подставим получим объединенный закон Фарадея.
m = 
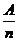 It,
It,
т. Е. масса выделившегося вещества прямо пропорциональна атомной массе силе тока и времени и обратно пропорциональна валентности вещества.
Если выделившаяся масса вещества численно равна заряду, который должен пройти через электролит, чтобы на электроде выделилась масса вещества, численно равная его химическому эквиваленту.
Электролиз применяется для выделения чистых металлов из пород (например алюминия из бокситов); изготовления электролитических конденсаторов; в гальваностегии- покрытии одного металла тонким слоем другого (никелирование, золочение и т.д.); в гальванопластике (изготовление точных рельефных копий изображений- значки, монеты, медали).При помощи электролиза осуществляют очистку металлов от примесей.
Не нашли, что искали? Воспользуйтесь поиском: