
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
HHHH HHHM HHMM HMMM MMMM
H4 H3M H2M2 HM3 M4
ЛДГ1, ЛДГ2, ЛДГ3, ЛДГ4, ЛДГ5.
Поскольку H-протомеры несут более выраженный отрицательный заряд, то изофермент H4 (ЛДГ1) будет мигрировать при электрофорезе с наибольшей скоростью к аноду.
С наименьшей скоростью к аноду будет двигаться М4.
Остальные изоферменты занимают промежуточное положение.
Изоферменты ЛДГ локализованы в различных тканях:
ЛДГ1,2 ----> мозг, аэробные ткани (миокард).
ЛДГ3 ----> лейкозные клетки.
ЛДГ4,5 ----> анэробные ткани: мышечная, скелетная.
Изоферменты появляются на различных этапах онтогенеза и реализуют программу индивидуального развития.
Изоферментный профиль меняется в процессе развития.
При патологиях имеется существенный изоферментный сдвиг.
Изоферменты. Часть ферментов состоят не из одной белковой цепочки, а из нескольких
субъединиц. Изоферменты – это семейство ферментов, которые катализируют одну и ту же
реакцию, но отличаются по строению и физико-химическим свойствам. Например: лактатде-
гидрогеназа (ЛДГ) состоит их 4 субъединиц 2х-типов: субъединица Н, выделенная из сер-
дечной мышцы (heart – сердце), субъединица М, выделенная из скелетных мышц (musculus –
мышца). Эти субъединицы кодируются разными генами. В разных органах имеются различ-
ные формы ЛДГ с различным набором субъединиц. Известно 5 изоферментов ЛДГ:
ЛДГ1: ЛДГ2: ЛДГ3: ЛДГ4: ЛДГ5:
(Н4) (Н3М) (Н2М2) (НМ3) (М4)
ЛДГ1 экспрессируется в сердечной мышце и мозге, а ЛДГ5 – в скелетных мышцах и печени.
Остальные формы в других органах. Появление ЛДГ в крови свидетельствует о повреждении
органов (фермент из разрушенных клеток поступает в кровь – гиперферментемия) Повыше-
ние активности фракции ЛДГ1 в крови наблюдается при повреждении сердечной мышцы
(инфаркт миокарда), а повышение активности ЛДГ5 в крови наблюдается при гепатитах и
повреждении скелетных мышц. То есть благодаря изоферментам можно определить локали-
зацию поврежденного органа. Наиболее чувствительным тестом на инфаркт миокарда явля-
ется повышение в крови сердечного изофермента креатинкиназы.
12. Мультиферментные комплексы это надмолекулярные образования которые включают,
несколько ферментов и коферментов. Они катализируют последовательные этапы реакции
преобразования одного субстрата. Примером мультиферментов являются реакции окисли-
тельного декарбоксилирования α-кетокислот (пирувата и α-кетоглутарата) под влиянием пи-
руватдегидрогеназы и α-кетоглутаратдегидрогеназы. Например пируватдегидрогеназный
комплекс включает 3 фермента и использует 5 коферментов
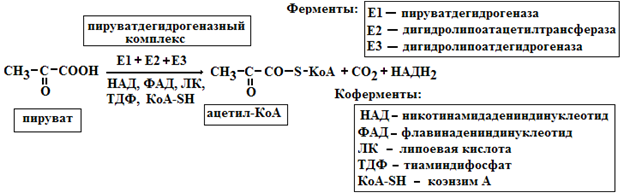
Биологическое значение мультиферментных комплексов состоит в том, что благодаря
их существованию облегчается перенос реагирующих веществ между отдельными ферментами и коферментами, что ускоряет протекание реакций. Мультиферментные комплексы, как правило, формируются на мембранах путем самосборки.
5.
Свойства ферментов как биокатализаторов:
1) Специфичность (избирательность) действия. Выделяют такие виды ее:
а) абсолютная специфичность – фермент катализирует превращение только одного субстрата (один фермент – один субстрат). Пример – уреаза, аргиназа, сахараза, лактаза и др.
б) стереоструктурная – фермент катализирует превращение определенного стереоизомера
(лактатдегидрогеназа превращает только L-лактат)
в) относительная – фермент катализирует превращение группы веществ с одним типом химической связи (один фермент – одна связь). Пример - пептидазы, эстеразы, гликозидазы.
2) Зависимость скорости ферментативной реакции от температуры. Ферментативные реакции, как и все химические реакции, ускоряются при повышении температуры (в 2-4 раза на каждые 10оС). Однако скорость ферментативной реакции имеет свой температурный оптимум, превышение которого приводит к понижению активности ферментов из-за тепловой
денатурации их молекул. Для большинства ферментативных реакций температурный оптимум - 38-40оС, а при 50-60оС и выше скорость ферментативных реакций сильно уменьшается из-за разрушения молекул фермента (искл. - миокиназа не инактивируется даже при 100 оС). Зависимость активности ферментов от температуры называется термолабильностью. Ферменты лучше сохраняются при низких температурах – их активность снижается, но денатурации не происходит. Это свойство используется в медицине для производства препаратов ферментов. При некоторых операциях необходимо снизить скорость обмена веществ. Тогда используют охлаждение органов (например, при пересадке почек, сердца и др. органов).
3) Зависимость ферментативной активности от рН среды. Каждый фермент имеет свой рН–оптимум - значение рН, при котором его активность максимальна. Фермент, как и любой белок, имеет в своей структуре ионогенные группы (например, карбоксильные группы или аминогруппы в боковых цепях), а от концентрация ионов водорода зависит их диссоциация исоотношение между положительно и отрицательно заряженными группами.

Соотношение между этими группами определяет и пространственное строение молекулы фермента (его конформацию), а следовательно, и его активность. Большинство ферментов наиболее активны при рН=6-8. Исключения - пепсин (рНопт=1,5-2), аргиназа (рНопт=10-11). 4) Ферменты ускоряют как прямую так и обратную реакции (например, лактатдегидрогеназа)
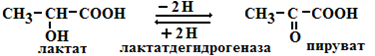
5) Активность ферментов может изменяться под влиянием различных веществ, которые могут повышать (активаторы) или снижать (ингибиторы) скорость катализируемой реакции.
6) Ферменты в отличие от небиологических катализаторов проявляют более высокую активность и проявляют свою способность ускорять реакции в очень маленьких концентрациях
(например, одна молекула карбангидразы способна расщепить 36 млн. молекул Н2СO3).
7) Ферменты, как и небиологические катализаторы, катализируют только те реакции, которые подчиняются II закону термодинамики и являются энергетически возможными. Ферменты не входят в состав конечных продуктов реакции, не влияют на константу равновесия реакции, а только увеличивают скорость ее достижения.
7.
Не нашли, что искали? Воспользуйтесь поиском: