
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Переваривание белков в кишечнике. 3 страница

Перенос одноуглеродных фрагментов к акцептору необходим не только для синтеза ряда соединений, но и для регенерации свободного Н4-фолата в печени.
Доказано, что коферментные функции ТГФК непосредственно связаны с переносом одноуглеродных групп, первичными источниками которых в организме являются β-углеродный атом серина, α-углеродный атом глицина, углерод метальных групп метионина, холина, 2-й углеродный атом индольного кольца триптофана, 2-й углеродный атом имидазольного кольца гистидина, а также формальдегид,муравьиная кислота и метанол. К настоящему времени открыто шесть одноуглеродных групп, включающихся в разнообразные биохимические превращения в составе ТГФК: формильная (—СНО), метильная (—СН3), метиленовая (—СН2—), метенильная (—СН=), оксиметильная (—СН2ОН) и формими-новая (—CH=NH). Выяснено, что присоединение этих фрагментов к ТГФК является ферментативной реакцией ковалентного связывания их с 5-м или 10-м атомом азота (или с обоими атомами вместе). Имеются данные, что производные ТГФК участвуют в переносе одно-углеродных фрагментов при биосинтезе метионина и тимина(перенос метильной группы), серина (перенос оксиметильной группы), образовании пуриновых нуклеотидов (перенос формильной группы) и т.д. Недостаточность фолиевой кислоты у человека возникает редко. Гиповитаминоз фолиевой кислоты приводит к нарушению обмена одноуглеродных фрагментов. Такое же нарушение наблюдается и при недостаточности витамина В12, использование которого связано с обменом фолиевой кислоты. Первое проявление дефицита фолиевой кислоты - мегалобластная (макроцитарная) анемия. Она характеризуется уменьшением количества эритроцитов, снижением содержания в них гемоглобина, что вызывает увеличение размера эритроцитов. Причина этих симптомов - нарушение синтеза ДНК и РНК из-за недостатка их предшественников - тимидиловой кислоты и пуриновых нуклеотидов вследствие дефицита производных Н4-фолата. Клетки кроветворной ткани быстро делятся, поэтому они в первую очередь реагируют на нарушение синтеза нуклеиновых кислот снижением скорости эритропоэза. Мегалобластная анемия возникает чаще всего в результате недостаточности фолиевой кислоты и/или витамина В12.
88. Антивитамины фолиевой кислоты. Механизм действия сульфаниламидных препаратов.
В медицинской практике (в частности, в онкологии) нашли применение некоторые синтетические аналоги (антагонисты) фолиевой кислоты. Так, метатрескат, казывает выраженное иммуносупрессивное действие даже в относительно низких дозах, не обладающих заметной гематологической токсичностью. Благодаря этому метотрексат шире, чем другие цитостатики с иммуносупрессивной активностью, применяется в качестве иммуносупрессивного препарата. Аминоптерин является наиболее активным цитостатиком-антагонистом фолиевой кислоты; отличается высокой токсичностью, вследствие чего показан лишь при тяжёлых формах псориаза.
Все современные сульфаниламидные препараты сходны между собой по спектру и механизму противомикробного действия. К ним весьма чувствительны стрептококки, стафилококки, пневмококки, гонококки, менингококки, кишечная, дизентерийная, дифтерийная и сибиреязвенная палочки, а также холерные вибрионы, бруцеллы и хламидии (возбудители трахомы и др.).
На микроорганизмы сульфаниламиды оказывают бактериостатическое влияние. Механизм бактериостатического действия сульфаниламидов заключается в том, что эти вещества, имея структурное сходство с пара-аминобензойной кислотой (ПАБК), оказываются ее конкурентными антагонистами. ПАБК необходима микроорганизмам для синтеза фолиевой кислоты, которая превращается в фолиниевую кислоту, участвующую в синтезе нуклеиновых кислот. Синтез нуклеиновых кислот, как известно, является основным фактором, обеспечивающим развитие и размножение любых клеток, в том числе микроорганизмов. Замещая ПАБК в процессе синтеза фолиевой кислоты, сульфаниламиды нарушают образование этой кислоты и таким образом препятствуют образованию нуклеиновых кислот, что сопровождается задержкой развития и размножения микроорганизмов.
Для развития клеток организма человека также необходима фолиевая кислота. Однако в отличие от микроорганизмов клетки человека сами не синтезируют фолиевую кислоту, а поглощают ее из крови, в которую эта кислота всасывается из кишечника. Этим объясняется тот факт, что клетки человека практически нечувствительны к действию сульфаниламидов в отличие от микроорганизмов.
Особенностями механизма действия сульфаниламидов объясняется также и то, что в средах с высоким содержанием ПАБК (кровь, гной) антибактериальная активность сульфаниламидов заметно снижается. Аналогичное явление наблюдается в случае применения сульфаниламидов совместно с лекарственными веществами, при распаде которых в организме выделяется ПАБК (например, с новокаином). Действие сульфаниламидов ослабляется также при совместном применении с фолиевой кислотой или с веществами, участвующими в ее синтезе (например, с метионином).
89. Обмен фенилаланина и тирозина. Фенилкетонурия; биохимический дефект, проявление болезни, методы предупреждения, диагностика и лечение.
Фенилаланин - незаменимая аминокислота, так как в клетках животных не синтезируется её бензольное кольцо. Тирозин - условно заменимая аминокислота, поскольку образуется из фенилаланина. Содержание этих аминокислот в пищевых белках (в том числе и растительных) достаточно велико. Фенилаланин и тирозин используются для синтеза многих биологически ктивных соединений. В разных тканях метаболизм этих аминокислот происходит по-разному.

Метаболизм феиилаланина
Основное количество фенилаланина расходуется по 2 путям:
- включается в белки;
- превращается в тирозин.
Превращение фенилаланина в тирозин прежде всего необходимо для удаления избытка фенилаланина, так как высокие концентрации его токсичны для клеток. Образование тирозина не имеет большого значения, так как недостатка этой аминокислоты в клетках практически не бывает. Основной путь метаболизма фенилаланина начинается с его гидроксилирования, в результате чего образуется тирозин. Эта реакция катализируется специфической монооксиге-назой - фенилаланингидр(жсилазой, кофермен-том которой служит тетрагидробиоптерин (Н4БП). Активность фермента зависит также от наличия Fe2+. Реакция необратима. Н4БП в результате реакции окисляется в дигидробиоптерин (Н2БП). Регенерация последнего происходит при участии дигидроптеридинредуктазы с использованием NADPH + H+. Обмен тирозина значительно сложнее, чем обмен фенилаланина. Кроме использования в синтезе белков, тирозин в разных тканях выступает предшественником таких соединений, как катехоламины, тироксин, меланины, и ка-таболизируется до СО2 и Н2О.
Катаболизм тирозина в печени
- В печени происходит катаболизм тирозина до конечных продуктов. Специфический путь катаболизма включает несколько ферментативных реакций, завершающихся образованием фумарата и ацетоацетата Трансаминирование тирозина с ос-кетоглутаратом катализирует тирозинаминотрансфе-раза (кофермент ПФ) - индуцируемый фермент печени млекопитающих. В результате образуется п-гидроксифенилпируват.
- В реакции окисления п-гидроксифенилпирувата в гомогентизиновую кислоту происходит декарбоксилирование, гидроксилирование ароматического кольца и миграция боковой цепи. Реакцию катализирует фермент n -гидроксифенилпируватдиоксигеназа, кофакторами которого выступают витамин С и Fe2+.
- Превращение гомогентизиновой кислоты в фумарилацетоацетат сопровождается расщеплением ароматического кольца. Эта реакция катализируется диоксигеназой гомогентизиновой кислоты, в качестве кофермента содержащей Fe2+.
Обмен фенилаланина и тирозина связан со значительным количеством реакций гидроксилирования, которые катализируют оксигеназы. Ферменты оксигеназы (гидроксилазы) используют молекулу О2 и кофермент-донор водорода (чаще - Н4БП). Для катализа оксигеназам необходимы кофакторы - Fe2+ или гем (для некоторых - Сu+), а для многих ещё и витамин С. Оксигеназы делят на 2 группы:
· Монооксигеназы - один атом О2 присоединяют к продукту реакции, другой используют для образования Н2О;
· Диоксигеназы - оба атома О2 используют для образования продукта реакции.
Почти все процессы расщепления ароматических колец в биологических системах катализируются диоксигеназами, подклассом ферментов, открытым японским биохимиком Осами Хайяши. В результате разрыва бензольного кольца образуется малеилацетоацетат, который в процессе цис- и транс-изомеризации превращается в фумарилацетоацетат.
- Гидролиз фумарилацетоацетата при действии фумарилацетоацетатгидролазы приводит к образованию фумарата и ацетоацетата. Фумарат может окисляться до СО2 и Н2О или использоваться для глюконеогенеза. Ацетоацетат - кетоновое тело, окисляемое до конечных продуктов с выделением энергии.
Превращение тирозина в меланоцитах. В пигментных клетках (меланоцитах) тирозин выступает предшественником тёмных пигментов - меланинов. Среди них преобладают 2 типа: эумеланины и феомеланины. Эумеланины (чёрного и коричневого цвета) - нерастворимые высокомолекулярные гетерополимеры 5,6-дигидроксииндола и некоторых его предшественников. Феомеланины - жёлтые или красновато-коричневые полимеры, растворимые в разбавленных щелочах. Находятся они, в основном, в составе волос. Меланины присутствуют в сетчатке глаз. Цвет кожи зависит от распределения меланоцитов и количества в них разных типов меланинов.
Превращение тирозина в щитовидной железе В щитовидной железе синтезируются и выделяются гормоны йодтиронины: тироксин (тетрайодтиронин) и трийодтиронин. Эти гормоны представляют собой йодированные остатки тирозина, которые попадают в клетки щитовидной железы через базальную мембрану
Превращения тирозина в надпочечниках и нервной ткани (синтез катехоламинов) В мозговом веществе надпочечников и нервной ткани тирозин является предшественником катехоламинов (дофамина, норадреналина и адреналина) При образовании катехоламинов, которое происходит в нервной ткани и надпочечниках, и меланина в меланоцитах промежуточным продуктом служит диоксифенилаланин (ДОФА). Однако гидроксилирование тирозина в клетках различных типов катализируется различными ферментами:
· Тирозиназа в меланоцитах является Сu+-зависимым ферментом (см. выше).
· Тирозингидроксилаза в надпочечниках и катехоламинергических нейронах не нуждается в ионах меди. Это - Fе2+-зависимый фермент, аналогично фенилаланингидроксилазе в качестве кофермента использующий Н4БП.
o Физиологическая роль тирозингидроксилазы чрезвычайно велика, так как этот фермент является регуляторным и определяет скорость синтеза катехоламинов.
o Активность тирозингидроксилазы значительно изменяется в результате:
o Аллостерической регуляции (ингибитор - норадреналин);
o Фосфорилирования/дефосфорилирования: в результате фосфорилирования с участием протеинкиназы А снижаются Кm для кофермента Н4БП и сродство фермента к норадреналину, в результате чего происходит активация тирозингидроксилазы.
o Количество фермента регулируется на уровне транскрипции.
· ДОФА-декарбоксилаза (кофермент - ПФ) катализирует образование дофамина, который при участии дофамингидроксилазы (монооксигеназы) превращается в норадреналин. Для функционирования фермента необходимы ионы Сu+, витамин С и тетрагидробиоптерин.
· В мозговом веществе надпочечников фенилэтаноламин-N-метилтрансфераза катализирует метилирование норадреналина, в результате чего образуется адреналин. Источником метальной группы служит SАМ.
Дофамин и норадреналин служат медиаторами в синаптической передаче нервных импульсов, а адреналин - гормон широкого спектра действия, регулирующий энергетический обмен. Одна из функций катехоламинов - регуляция деятельности ССС
Фенилкетонурия В печени здоровых людей небольшая часть фенилаланина (∼10%) превращается в фенил-лактат и фенилацетилглутамин. Этот путь катаболизма фенилаланина становится главным при нарушении основного пути - превращения в тирозин, катализируемого фенил-аланингидроксилазой. Такое нарушение сопровождается гиперфенилаланинемией и повышением в крови и моче содержания метаболитов альтернативного пути: фенилпирувата, фенилацетата, фениллактата и фенилацетилглу-тамина.

Дефект фенилаланингидроксилазы приводит к заболеванию фенилкетонурия (ФКУ). Выделяют 2 формы ФКУ:
· Классическая ФКУ - наследственное заболевание, связанное с мутациями в гене фенилаланингидроксилазы, которые приводят к снижению активности фермента или полной его инактивации. При этом концентрация фенилаланина повышается в крови в 20-30 раз (в норме - 1,0-2,0 мг/дл), в моче - в 100-300 раз по сравнению с нормой (30 мг/дл). Концентрация фенилпирувата и фениллактата в моче достигает 300-600 мг/дл при полном отсутствии в норме.Наиболее тяжёлые проявления ФКУ - нарушение умственного и физического развития, судорожный синдром, нарушение пигментации. При отсутствии лечения больные не доживают до 30 лет. Частота заболевания - 1:10 000 новорождённых. Заболевание наследуется по аутосомно-рецессивному типу. Тяжёлые проявления ФКУ связаны с токсическим действием на клетки мозга высоких концентраций фенилаланина, фенилпирувата, фениллактата. Большие концентрации фенилаланина ограничивают транспорт тирозина и триптофана через гематоэнцефаличеекий барьер и тормозят синтез нейро-медиаторов (дофамина, норадреналина, серотонина).
· Вариантная ФКУ (коферментзависимая гиперфенилаланинемия) - следствие мутаций в генах, контролирующих метаболизм Н4БП. Клинические проявления - близкие, но не точно совпадающие с проявлениями классической ФКУ. Частота заболевания - 1-2 случая на 1 млн новорождённых. Н4БП необходим для реакций гидроксилирования не только фенилаланина, но также тирозина и триптофана, поэтому при недостатке этого кофермента нарушается метаболизм всех 3 аминокислот, в том числе и синтез ней-ромедиаторов. Заболевание характеризуется тяжёлыми неврологическими нарушениями и ранней смертью ("злокачественная" ФКУ).
Прогрессирующее нарушение умственного и физического развития у детей, больных ФКУ, можно предотвратить диетой с очень низким содержанием или полным исключением фенилаланина. Если такое лечение начато сразу после рождения ребёнка, то повреждение мозга предотвращается. Считается, что ограничения в питании могут быть ослаблены после 10-летнего возраста (окончание процессов миелинизации мозга), однако в настоящее время многие педиатры склоняются в сторону "пожизненной диеты". Для диагностики ФКУ используют качественные и количественные методы обнаружения патологических метаболитов в моче, определение концентрации фенилаланина в крови и моче. Дефектный ген, ответственный за фенилкетонурию, можно обнаружить у фенотипически нормальных гетерозиготных носителей с помощью теста толерантности к фенилаланину. Для этого обследуемому дают натощак ∼10 г фенилаланина в виде раствора, затем через часовые интервалы берут пробы крови, в которых определяют содержание тирозина. В норме концентрация тирозина в крови после фенилаланиновой нагрузки значительно выше, чем у гетерозиготных носителей гена фежилкетонурии. Этот тест используется в генетической консультации для определения риска рождения больного ребёнка. Разработана схема скрининга для выявления новорождённых детей с ФКУ. Чувствительность теста практически достигает 100%. В настоящее время диагностику мутантного гена, ответственного за ФКУ, можно проводить с помощью методов ДНК-диагностики (рестрикционного анализа и ПЦР).
90. Алкаптонурия и альбинизм: биохимические дефекты, при которых они развиваются. Нарушение синтеза дофамина, паркинсонизм.

Алкаптонурия ("чёрная моча"). Причина заболевания - дефект диоксигеназы гомогентизиновой кислоты (4). Для этой болезни характерно выделение с мочой большого количества гомогентизиновой кислоты, которая, окисляясь кислородом воздуха, образует тёмные пигменты алкаптоны. Это метаболическое нарушение было описано ещё в XVI веке, а само заболевание охарактеризовано в 1859 г. Клиническими проявлениями болезни, кроме потемнения мочи на воздухе, являются пигментация соединительной ткани (охроноз) и артрит. Частота - 2-5 случаев на 1 млн новорождённых. Заболевание наследуется по аутосомнорецессивному типу. Диагностических методов выявления гетерозиготных носителей дефектного гена к настоящему времени не найдено.
Альбинизм Причина метаболического нарушения - врождённый дефект тирозиназы (3). Этот фермент катализирует превращение тирозина в ДОФА в меланоцитах. В результате дефекта тирозиназы нарушается синтез пигментов меланинов. Клиническое проявление альбинизма (от лат. albus - белый) - отсутствие пигментации кожи и волос. У больных часто снижена острота зрения, возникает светобоязнь. Длительное пребывание таких больных под открытым солнцем приводит к раку кожи. Частота заболевания 1:20 000.
Нарушение синтеза катехоламинов может вызывать различные нервно-психические заболевания, причём патологические отклонения наблюдаются как при снижении, так и при увеличении их количества.
Болезнь Паркинсона. Заболевание развивается при недостаточности дофамина в чёрной субстанции мозга. Это одно из самых распространённых неврологических заболеваний (частота 1:200 среди людей старше 60 лет). При этой патологии снижена активность тирозингидроксилазы, ДОФА-декарбоксилазы. Заболевание сопровождается тремя основными симптомами: акинезия (скованность движений), ригидность (напряжение мышц), тремор (непроизвольное дрожание). Дофамин не проникает через гематоэнцефалический барьер и как лекарственный препарат не используется. Для лечения паркинсонизма предлагаются следующие принципы:
- заместительная терапия препаратами-предшественниками дофамина (производными ДОФА) - леводопа, мадопар, наком и др.
- подавление инактивации дофамина ингибиторами МАО (депренил, ниаламид, пиразидол и др.).
Депрессивные состояния часто связаны со снижением в нервных клетках содержания дофамина и норадреналина.
Гиперсекреция дофамина в височной доле мозга наблюдается при шизофрении.
91. Декарбоксилирование аминокислот. Структура биогенных аминов (гистамин, серотонин, γ-аминомасляная кислота, катехоламины). Функции биогенных аминов.
Процесс отщепления карбоксильной группы аминокислот в виде СО2 получил название декарбоксилирования. В живых организмах открыты 4 типа декарбоксилирования аминокислот:
1. α-Декарбоксилирование, характерное для тканей животных, при котором от аминокислот отщепляется карбоксильная группа, стоящая по соседству с α-углеродным атомом. Продуктами реакции являются СО2 и биогенные амины:

2. ω-Декарбоксилирование, свойственное микроорганизмам. Например, из аспарагиновой кислоты этим путем образуется α-аланин:

3. Декарбоксилирование, связанное с реакцией трансаминирования:

В этой реакции образуются альдегид и новая аминокислота, соответствующая исходной кетокислоте.
4. Декарбоксилирование, связанное с реакцией конденсации двух молекул:

Эта реакция в тканях животных осуществляется при синтезе δ-амино-левулиновой кислоты из глицина и сукцинил-КоА и при синтезе сфинголипидов, а также у растений при синтезе биотина.
Реакции декарбоксилирования в отличие от других процессов промежуточного обмена аминокислот являются необратимыми. Они катализируются специфическими ферментами – декарбоксилазами аминокислот, отличающимися от декарбоксилаз α-кетокислот как белковым компонентом, так и природой кофермента. Декарбоксилазы аминокислот состоят из белковой части, обеспечивающей специфичность действия, и простетической группы, представленной пиридоксальфосфатом (ПФ), как и у трансаминаз. Некоторые аминокислоты и их производные могут подвергаться декарбоксилированию - отщеплению карбоксильной группы. В тканях млекопитающих декарбоксилированию может подвергаться целый ряд аминокислот или их производных: Три, Тир, Вал, Гис, Глу, Цис, Apr, Орнитин, SAM, ДОФА, 5-окситриптофан и др. Продуктами реакции являются СО2 и амины, которые оказывают выраженное биологическое действие на организм (биогенные амины):
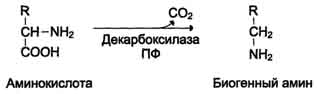
Реакции декарбоксилирования необратимы и катализируются ферментами декарбоксилазами. Простетическая группа декарбоксилаз в клетках животных - пиридоксальфосфат. Амины, образовавшиеся при декарбоксилировании аминокислот, часто являются биологически активными веществами. Они выполняют функцию нейромедиаторов (серотонин, дофамин, ГАМК и др.), гормонов (норадреналин, адреналин), регуляторных факторов местного действия (гистамин, карнозин, спермин и др.)
Серотонин - нейромедиатор проводящих путей. Образуется в надпочечниках и ЦНС из аминокислоты 5-гидрокситриптофана в результате действия декарбоксилазы ароматических аминокислот. Этот фермент обладает широкой специфичностью и способен также декарбоксилировать триптофан и ДОФА, образующийся из тирозина. 5-Гидрокситриптофан синтезируется из триптофана под действием фенилаланингидроксилазы с коферментом Н4БП (этот фермент обладает специфичностью к ароматическим аминокислотам и гидроксидирует также фенилаланин) Серотонин может превращаться в гормон мелатонин, регулирующий суточные и сезонные изменения метаболизма организма и участвующий в регуляции репродуктивной функции.

Серотонин - биологически активное вещество широкого спектра действия. Он стимулирует сокращение гладкой мускулатуры, оказывает сосудосуживающий эффект, регулирует АД, температуру тела, дыхание, обладает антидепрессантным действием. По некоторым данным он может принимать участие в аллергических реакциях, поскольку в небольших количествах синтезируется в тучных клетках.
Гистамин образуется путем декарбоксилирования гистидина в тучных клетках соединительной ткани

Гистамин образует комплекс с белками и сохраняется в секреторных гранулах тучных клеток. Секретируется в кровь при повреждении ткани (удар, ожог, воздействие эндо- и экзогенных веществ), развитии иммунных и аллергических реакций. Гистамин выполняет в организме человека следующие функции:
- стимулирует секрецию желудочного сока, слюны (т.е. играет роль пищеварительного гормона);
- повышает проницаемость капилляров, вызывает отёки, снижает АД (но увеличивает внутричерепное давление, вызывает головную боль);
- сокращает гладкую мускулатуру лёгких, вызывает удушье;
- участвует в формировании воспалительной реакции - вызывает расширение сосудов, покраснение кожи, отёчность ткани;
- вызывает аллергическую реакцию;
- выполняет роль нейромедиатора;
- является медиатором боли.
В клинической практике широко используется, кроме того, продукт α-декарбоксилирования глутаминовой кислоты – γ-аминомасляная кислота (ГАМК). Фермент, катализирующий эту реакцию (глутаматдекарбокси-лаза), является высокоспецифичным.

Интерес к ГАМК объясняется ее тормозящим действием на деятельность ЦНС. Больше всего ГАМК и глутаматдекарбоксилазы обнаружено в сером веществе коры большого мозга, в то время как белое вещество мозга и периферическая нервная система их почти не содержат. Введение ГАМК в организм вызывает разлитой тормозной процесс в коре (центральное торможение) и у животных приводит к утрате условных рефлексов. ГАМК используется в клинике как лекарственное средство при некоторых заболеваниях ЦНС, связанных с резким возбуждением коры большого мозга. Так, при эпилепсии хороший эффект (резкое сокращение частоты эпилептических припадков) дает введение глутаминовой кислоты. Как оказалось, лечебный эффект обусловлен не самой глутаминовой кислотой, а продуктом ее декарбоксилирования – ГАМК.
92. Дезаминирование и гидроксилирование биогеных аминов (как реакции обезвреживания этих соединений).
Для осуществления биологической функции в нервных клетках требуется определённая концентрация отклонения. В связи с этим большое значение приобретают механизмы инактивации биогенных аминов.
Инактивация биогенных аминов происходит двумя путями:
- 1) метилированием с участием SAM под действием метилтрансфераз. Таким образом могут инактивироваться различные биогенные амины, но чаще всего происходит инактивация гастамина и адреналина. Так, инактивация адреналина происходит путём метилирования гидроксильной группы в ортоположении.

Реакция инактивации гистамина также преимущественно происходит путём метилирования

- 2) окислением ферментами моноаминооксидазами (МАО) с коферментом FAD - таким путем. Чаще происходит инактивация дофамина, норадреналина, серотонина, ГАМК. При этом происходит окислительное дезаминирование биогенных аминов с образованием альдегидов, а затем соответствующих кислот, которые выводятся почками

93. Нуклеиновые кислоты, химический состав, строение. Первичная структура ДНК и РНК, связи, формирующие первичную структуру
Нуклеи́новые кисло́ты — высокомолекулярные органические соединения, биополимеры (полинуклеотиды), образованные остатками нуклеотидов. Нуклеиновые кислоты ДНК и РНК присутствуют в клетках всех живых организмов и выполняют важнейшие функции по хранению, передаче и реализации наследственной информации. Нуклеиновые кислоты хорошо растворимы в воде, практически не растворимы в органических растворителях. Очень чувствительны к действию температуры и критических значений уровня pH. Молекулы ДНК с высокой молекулярной массой, выделенные из природных источников, способны фрагментироваться под действием механических сил, например при перемешивании раствора. Нуклеиновые кислоты фрагментируются ферментами — нуклеазами. Полимерные формы нуклеиновых кислот называют полинуклеотидами. Цепочки из нуклеотидов соединяются через остаток фосфорной кислоты (фосфодиэфирная связь). Поскольку в нуклеотидах существует только два типа гетероциклических молекул, рибоза и дезоксирибоза, то и имеется лишь два вида нуклеиновых кислот — дезоксирибонуклеиновая (ДНК) и рибонуклеиновая (РНК). Мономерные формы также встречаются в клетках и играют важную роль в процессах передачи сигналов или запасании энергии. Наиболее известный мономер РНК — АТФ, аденозинтрифосфорная кислота, важнейший аккумулятор энергии в клетке
Первичная структура ДНК - порядок чередования дезоксирибонуклеозидмонофосфатов в полинукпеотидной цепи.
Каждая фосфатная группа в полинукпеотидной цепи, за исключением фосфорного остатка на 5'-конце молекулы, участвует в образовании двух эфирных связей с участием 3'- и 5'-углеродных атомов двух соседних дезоксирибоз, поэтому связь между мономерами обозначают 3', 5'-фосфодиэфирной.
Концевые нуклеотиды ДНК различают по структуре: на 5'-конце находится фосфатная группа, а на 3'-конце цепи - свободная ОН-группа. Эти концы называют 5'- и 3'-концами. Линейная последовательность дезоксирибонуклеотидов в полимерной цепи ДНК обычно сокращённо записывают с помощью однобуквенного кода, например -A-G-C-T-T-A-C-A- от 5'- к 3'-концу.
В каждом мономере нуклеиновой кислоты присутствует остаток фосфорной кислоты. При рН 7 фосфатная группа полностью ионизирована, поэтому in vivo нуклеиновые кислоты существуют в виде полианионов (имеют множественный отрицательный заряд). Остатки пентоз тоже проявляют гидрофильные свойства. Азотистые основания почти нерастворимы в воде, но некоторые атомы пуринового и пиримидинового циклов способны образовывать водородные связи.
Не нашли, что искали? Воспользуйтесь поиском: