
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Генетический код и его свойства
Необходимость кодирования структуры белков в линейной последовательности нуклеотидов мРНК и ДНК продиктована тем, что в ходе трансляции:
- нет соответствия между числом мономеров в матрице мРНК и продукте - синтезируемом белке;
- отсутствует структурное сходство между мономерами РНК и белка.
Это исключает комплементарное взаимодействие между матрицей и продуктом - принцип, по которому осуществляется построение новых молекул ДНК и РНК в ходе репликации и транскрипции. Отсюда становится ясным, что должен существовать "словарь", позволяющий выяснить, какая последовательность нуклеотидов мРНК обеспечивает включение в белок аминокислот в заданной последовательности. Этот "словарь" получил название генетического, биологического, нуклеотидного, или аминокислотного кода. Он позволяет шифровать аминокислоты, входящие в состав белков, с помощью определённой последовательности нуклеотидов в ДНК и мРНК. Для него характерны определённые свойства.
Триплетность. Одним из основных вопросов при выяснении свойств кода был вопрос о числе нуклеотидов, которое должно определять включение в белок одной аминокислоты. Сразу было понятно, что это число не может быть равным 1 или 2, так как в этом случае количество кодирующих элементов будет недостаточным для шифрования 20 аминокислот в белках. Число кодирующих последовательностей из четырёх нуклеотидов по три равно 43 = 64, что более чем в 3 раза превышает минимальное количество, которое необходимо для кодирования 20 аминокислот. В дальнейшем было установлено, что кодирующими элементами в шифровании аминокислотной последовательности действительно являются тройки нуклеотидов, или триплеты, которые получили название "кодоны".
Смысл кодонов. Смысл кодонов стал понятен в 60-х г. XX столетия, когда, используя бесклеточную систему синтеза белков и синтетические полирибонуклеотиды с заданной последовательностью нуклеотидов в качестве матрицы, М. Ниренберг и Г. Маттеи синтезировали полипептиды определённого строения. Так, на матрице поли-У, состоящей только из остатков УМФ, был получен полифенилаланин, а на матрице поли-Ц - полипролин. Из этого следовало, что триплет -UUU кодирует Фен, а триплет -ССС - Про. В последующих экспериментах использовали смешанные синтетические полирибонуклеотиды с известным составом. В результате этой работы удалось установить, что из 64 кодонов включение аминокислот в синтезирующуюся полипептидную цепь шифрует 61 триплет, а 3 остальных - UAA, UAG, UGA не кодируют включение в белок аминокислот и первоначально были названы бессмысленными, или нон-сенс-кодонами. Однако в дальнейшем было показано, что эти триплеты сигнализируют о завершении трансляции, и поэтому их стали называть терминирующими, или стоп - кодонами. Кодоны мРНК и триплеты нуклеотидов в кодирующей нити ДНК с направлением от 5' к 3'-концу имеют одинаковую последовательность азотистых оснований, за исключением того, что в ДНК вместо урацила (U), характерного для мРНК, стоит тимин (Т).
Специфичность. Каждому кодону соответствует только одна определённая аминокислота. В этом смысле генетический код строго однозначен.
Вырожденность. В мРНК и ДНК имеет смысл 61 триплет, каждый из которых кодирует включение в белок одной из 20 аминокислот. Из этого следует, что в информационных молекулах включение в белок одной и той же аминокислоты определяют несколько кодонов. Это свойство биологического кода получило название вырожденности. У человека одним кодоном зашифрованы только 2 аминокислоты - Мет и Три, тогда как Лей, Сер и Apr - шестью кодонами, а Ала, Вал, Гли, Про, Тре - четырьмя кодонами. Избыточность кодирующих последовательностей - ценнейшее свойство кода, так как она повышает устойчивость информационного потока к неблагоприятным воздействиям внешней и внутренней среды. При определении природы аминокислоты, которая должна быть включена в белок, третий нуклеотид в кодоне не имеет столь важного значения, как первые два.
Линейность записи информации. В ходе трансляции кодоны мРНК "читаются" с фиксированной стартовой точки последовательно и не перекрываются. В записи информации отсутствуют сигналы, указывающие на конец одного кодона и начало следующего. Кодон AUG является инициирующим и прочитывается как в начале, так и в других участках мРНК как Мет. Следующие за ним триплеты читаются последовательно без каких-либо пропусков вплоть до стоп-кодона, на котором синтез полипептидной цепи завершается.
Универсальность. До недавнего времени считалось, что код абсолютно универсален, т.е. смысл кодовых слов одинаков для всех изученных организмов: вирусов, бактерий, растений, земноводных, млекопитающих, включая человека. Однако позднее стало известно одно исключение, оказалось, что митохондриальная мРНК содержит 4 триплета, имеющих другое значение, чем в мРНК ядерного происхождения. Так, в мРНК митохондрий триплет UGA кодирует Три, AUA - Мет, а АСА и AGG прочитываются как дополнительные стоп-кодоны.
Колинеарностьгенаипродукта. У прокариотов обнаружено линейное соответствие последовательности кодонов гена и последовательности аминокислот в белковом продукте, или, как говорят, существует колинеарность гена и продукта. У эукариотов последовательности оснований в гене, колинеарные аминокислотной последовательности в белке, прерываются нитронами. Поэтому в эукариотических клетках аминокислотная последовательность белка колинеарна последовательности экзонов в гене или зрелой мРНК после посттранскригщионного удаления интронов.
108. Роль транспортных РНК в биосинтезе белков. Биосинтез аминоацил-т-РНК. Субстратная специфичность аминоацил-т-РНК-синтетаз.
тРНК. У человека около 50 различных тРНК обеспечивают включение аминокислот в белок. тРНК называют " адапторные молекулы", так как к акцепторному концу этих молекул может быть присоединена определённая аминокислота, а с помощью антикодона они узнают специфический кодон на мРНК. В процессе синтеза белка на рибосоме связывание антикодонов тРНК с кодонами мРНК происходит по принципу комплементарности и антипараллельности. Однако оказалось, что число тРНК для каждой аминокислоты не совпадает с числом кодирующих её кодонов в мРНК, и, следовательно, некоторые тРНК способны связываться больше чем с одним кодоном.
Исследование этого вопроса позволило установить следующее:
- первые два основания кодона и последние два основания антикодона образуют обычные прочные пары (гуанинцитозин и аденинурацил) и вносят наибольший вклад в специфичность декодирования;
- связывание третьего основания кодона с первым основанием антикодона происходит слабее, чем с первыми двумя, и это позволяет некоторым тРНК прочитывать больше чем один кодон.
Гипотеза, объясняющая характер кодонан-тикодонового взаимодействия, получила название "гипотезы качания" (т.е. третье основание большинства кодонов имеет определённую степень свободы при образовании пары с соответствующим антикодоном и как бы "качается"). Так, например, одна из аргининовых тРНК имеет антикодон 5'-I-C-G-3', который может узнавать 3 разных аргининовых кодона
Аминоацил-тРНК синтетазы (аминоацил-тРНК лигазы). В цитозоле клеток 20 различных аминокислот присоединяются α-карбоксильной группой к 3'-гидроксильному акцепторному концу соответствующих тРНК с образованием сложноэфирной связи. Эти реакции катализирует семейство ферментов, носящее название аминоацил-тРНК синтетаз (аа-тРНК-синтетаз). Каждый член этого семейства узнаёт только одну определённую аминокислоту и те тРНК, которые способны связываться с этой аминокислотой. Из этого следует, что в группу тРНК синтетаз входит 20 различных ферментов. Они осуществляют активацию аминокислот в 2 стадии: на первой стадии аминокислота присоединяется к ферменту и реагирует с АТФ с образованием богатого энергией промежуточного соединения - аминоацил-АМФ. На второй стадии аминоацильный остаток аминоациладенилата, оставаясь связанным с ферментом, взаимодействует с молекулой соответствующей тРНК с образованием аминоацил-тРНК.
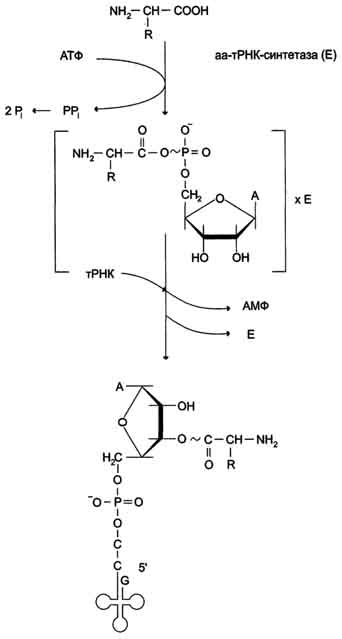
Суммарную реакцию, катализируемую аминоацил-тРНК синтетазами в присутствии ионов Mg2+, можно представить следующим образом:
Аминокислота +тРНК + АТФ -> аминоацил - тРНК + АМФ + PPi.
Для каждой аминокислоты существует свой фермент - своя аминоацил тРНК синтетаза: для глутамата - глутамил-тРНК синтетаза, гистидина - гистидил-тРНК синтетаза и т.д. Аминокислоты присоединяются к 3'- или 2'-ОН группам рибозы на 3'-конце тРНК, где все тРНК имеют общую нуклеотидную последовательность -ССА. Энергия, заключённая в макроэргической сложноэфирной связи аминоацил-тРНК, впоследствии используется на образование пептидной связи в ходе синтеза белка. Пирофосфат, выделяющийся в ходе этой реакции, гидролитически расщепляется с образованием двух молекул ортофосфата и выделением энергии, что делает реакцию активации аминокислот необратимой. Чрезвычайно высокая специфичность аа-тРНК синтетаз в связывании аминокислоты с соответствующими тРНК лежит в основе точности трансляции генетической информации. В активном центре этих ферментов есть 4 специфических участка для узнавания: аминокислоты, тРНК, АТФ и четвёртый - для присоединения молекулы Н2О, которая участвует в гидролизе неправильных аминоациладенилатов. За счёт существования в активном центре этих ферментов корректирующего механизма, обеспечивающего немедленное удаление ошибочно присоединённого аминокислотного остатка, достигается поразительно высокая точность работы: на 1300 связанных с тРНК аминокислот встречается только одна ошибка. Аминокислота, присоединяясь к тРНК, в дальнейшем не определяет специфических свойств аа-тРНК, так как её структуру не узнаёт ни рибосома, ни мРНК. Участие в синтезе белка зависит только от структуры тРНК, а точнее, от комплементарного взаимодействия антикодона аминоацил-тРНК с кодоном мРНК. Антикодон расположен в центральной (антикодоновой) петле тРНК. Узнавание тРНК аа-тРНК синтетазами не всегда происходит по антикодоновой петле. Активный центр некоторых ферментов обнаруживает комплементарное соответствие другим участкам пространственной структуры тРНК.
109. Последовательность событий на рибосоме при сборке полипептидной цепи. Функционирование полирибосом. Посттрансляционный процессинг белков.
В ходе синтеза белка прочтение информации мРНК идёт в направлении от 5'- к З'-концу, обеспечивая синтез пептида от N- к С-концу. Каждая эукариотическая мРНК кодирует строение только одной полипептидной цепи (т.е. она моноцистронна), в отличие от прокариотических мРНК, которые часто содержат информацию о нескольких пептидах (т.е. они поли-цистронны). Эти различия вызваны тем, что у прокариотов ДНК лишена интронов, и РНК-полимераза транскрибирует участки, прочтение информации с которых подчиняется общему регуляторному механизму. Кроме того, на полицистронных мРНК синтез белка начинается до того, как заканчивается их собственный синтез, так как процессы транскрипции и трансляции не разделены. У эукариотов трансляция протекает в цитоплазме, куда из ядра поступают уже "зрелые" мРНК. События на рибосоме включают этапы: инициации, элонгации и терминации.
Инициация. Инициация трансляции представляет собой событие, в ходе которого происходит образование комплекса, включающего Мет-тРНКiМет, мРНК и рибосому, где тРНКiМет - инициирующая метиониновая тРНК. В этом процессе участвуют не менее 10 факторов инициации, которые обозначают как elF (от англ. eukaryotic initiation factors) с указанием номера и буквы. Первоначально 40S субъединица рибосомы соединяется с фактором инициации, который препятствует ее связыванию с 60S субъединицей, но стимулирует объединение с тройным комплексом, включающим Мет-тРНКiМет, eIF-2 и ГТФ. Затем этот теперь уже более сложный комплекс связывается с 5'-концом мРНК при участии нескольких elF. Один из факторов инициации (eIF-4F) узнаёт и присоединяется к участку "кэп" на молекуле мРНК, поэтому он получил название кэпсвязывающе-го белка. Прикрепившись к мРНК, 40S субъединица начинает скользить по некодирующей части мРНК до тех пор, пока не достигнет инициирующего кодона AUG кодирующей нуклеотидной последовательности. Скольжение 40S субъединицы по мРНК сопровождается гидролизом АТФ, энергия которого затрачивается на преодоление участков спирализации в нетранслируемой части мРНК. В эукариотических клетках некодирующие участки мРНК имеют разную длину, но обычно от 40 до 80 нуклеотидов, хотя встречаются области с протяжённостью более 700 нуклеотидов. Достигнув начала кодирующей последовательности мРНК, 40S субъединица останавливается и связывается с другими факторами инициации, ускоряющими присоединение 60S субъединицы и образование 80S рибосомы за счёт гидролиза ГТФ до ГДФ и неорганического фосфата. При этом формируются А- и Р-центры рибосомы, причём в Р-центре оказывается AUG-кодон мРНК с присоединённым к нему Мет-тРНКiМет. В клетках есть 2 различающиеся по структуре тРНК, узнающие кодон AUG. Инициирующий кодон узнаёт тРНКiМет, а триплеты мРНК, кодирующие включение метионина во внутренние участки белка, прочитываются другой тЗРКМет
Элонгация. По завершении инициации рибосома располагается на мРНК таким образом, что в Р-центре находится инициирующий кодон AUG с присоединённой к нему Мет-тРНКшМет, а в А-центре - триплет, кодирующий включение первой аминокислоты синтезируемого белка. Далее начинается самый продолжительный этап белкового синтеза - элонгация, в ходе которого рибосома с помощью аа-тРНК последовательно "читает" мРНК в виде триплетов нуклеоти-дов, следующих за инициирующим кодоном в направлении от 5' к 3'-концу, наращивая полипептидную цепочку за счёт последовательного присоединения аминокислот.
Включение каждой аминокислоты в белок происходит в 3 стадии, в ходе которых:
- аа-тРНК каждой входящей в белок аминокислоты связывается с А-центром рибосомы;
- пептид от пептидил-тРНК, находящейся в Р-центре, присоединяется к α-NH2-гpyппe аминоацильного остатка аа-тРНК А-центра с образованием новой пептидной связи;
- удлинённая на один аминокислотный остаток пептидил-тРНК перемещается из А-центра в Р-центр в результате транслокации рибосомы.
Связывание аминоацил-тРНК в А-центре. Кодон мРНК, располагающийся в А-центре рядом с инициирующим кодоном, определяет природу аа1тРНКaa1, которая будет включена в А-центр. аа1тРНКaa1 взаимодействует с рибосомой в виде тройного комплекса, состоящего из фактора элонгации EF-1, аа1тРНКaa1 и ГТФ. Комплекс эффективно взаимодействует с рибосомой лишь в том случае, если антикодон аа-тРНКaa1 комплементарен и антипараллелен ко-дону мРНК в А-центре. Включение аа-тРНКaa1 в рибосому происходит за счёт энергии гидролиза ГТФ до ГДФ и неорганического фосфата
Образование пептидной связи происходит сразу же после отщепления комплекса EF-1 и ГДФ от рибосомы. Эта стадия процесса получила название реакции транспептидации. В ходе этой реакции остаток метионина Мет-тРНКIМет связывается с a-аминогругшой первой аминокислоты, присоединённой к тРНКaa1 и расположенной в А-центре, образуется первая пептидная связь. Установлено, что пептидилтрансферазная активность большой субъединицы рибосомы принадлежит 28S рРНК. К настоящему времени обнаружена целая группа РНК, обладающая свойствами ферментов. Эти каталитически активные РНК получили название рибозимов. Полагают, что рибозимы можно считать "реликтами" раннего периода эволюции, когда белки ещё не приобрели такого значения, как в последующие периоды.
Транслокация - третья стадия элонгации. К рибосоме присоединяется фактор элонгации EF-2 и за счёт энергии ГТФ продвигает рибосому по мРНК на один кодон к 3'-концу. В результате дипептидил-тРНК, которая не меняет своего положения относительно мРНК, из А-центра перемещается в Р-центр. Свободная от метионина тРНКiМет покидает рибосому, а в область А-центра попадает следующий кодон. По завершении третьей стадии элонгации рибосома в Р-центре имеет дипептидил-тРНК, а в А-центр попадает триплет, кодирующий включение в полипептидную цепь второй аминокислоты. Начинается следующий цикл стадии элонгации, в ходе которого на рибосоме снова проходят вышеописанные события. Повторение таких циклов по числу смысловых кодонов мРНК завершает весь этап элонгации.
Терминация. Терминация трансляции наступает в том случае, когда в А-центр рибосомы попадает один из стоп-кодонов: UAG, UAA или UGA. Для стоп-кодонов нет соответствующих тРНК. Вместо этого к рибосоме присоединяются 2 белковых высвобождающих фактора RF (от англ, releasingfactor) или фактора терминации. Один из них с помощью пептидилтрансферазного центра катализирует гидролитическое отщепление синтезированного пептида от тРНК. Другой за счёт энергии гидролиза ГТФ вызывает диссоциацию рибосомы на субъединицы. Интересно отметить, что факторы трансляции, реализующие эффекты за счёт гидролиза ГТФ, являются членами суперсемейства G-белков, в которое входят G-белки, участвующие в трансдукции сигналов гормонов и других биологически активных веществ, и Ras-белки, функционирующие как факторы роста. Все G-белки связывают и гидролизуют ГТФ. Когда они связаны с ГТФ, то активны и участвуют в соответствующих метаболических процессах, а когда в активном центре в результате гидролиза ГТФ превращается в ГДФ, эти белки приобретают неактивную конформацию. Таким образом, матричная природа процесса трансляции проявляется в том, что последовательность поступления аминоацил-тРНК в рибосому для синтеза белка строго детерминирована мРНК, т.е. порядок расположения кодонов вдоль цепи мРНК однозначно задаёт структуру синтезируемого белка. Рибосома сканирует цепь мРНК в виде триплетов и последовательно отбирает из окружающей среды "нужные" аа-тРНК, освобождая в ходе элонгации деацилированные тРНК. Малая и большая субъединицы рибосомы в процессе трансляции выполняют разные функции: малая субъединица присоединяет мРНК и декодирует информацию с помощью тРНК и механизма транслокации, а большая субъединица ответственна за образование пептидных связей.
В процессе синтеза белка рибосома присоединяется к 5'-концу мРНК и перемещается в направлении 3'-конца. При этом 5'-конец мРНК освобождается, и к нему может присоединиться новая рибосома, на которой начинается рост ещё одной полипептидной цепи. Как правило, много рибосом одновременно участвует в синтезе белка на одной и той же мРНК, образуя комплекс, который называют полирибосомой, или полисомой. Каждая рибосома занимает на мРНК участок длиной около 80 нуклеотидов, поэтому рибосомы располагаются на мРНК с интервалом примерно в 100 нуклеотидов. Чем длиннее полипептидная цепочка синтезируемого белка, тем больше рибосом может одновременно осуществлять синтез этого белка, значительно увеличивая таким образом эффективность использования матрицы.
Каждая рибосома способна катализировать образование около 100 пептидных связей в минуту. Полирибосомы могут существовать в виде частиц, плавающих в щггоплазме клеток, или могут быть связаны с ЭР. Свободные цитоготазматические полирибосомные частицы ответственны за синтез белков, выполняющих внутриклеточные функции. Полирибосомы, ассоциированные с ЭР, под электронным микроскопом имеют вид "шероховатой" поверхности. Белки, синтезируемые "шероховатым" ЭР, должны транспортироваться через мембрану для того, чтобы они достигли места окончательной локализации. Для них характерно присутствие на N-конце лидер-ной, или сигнальной, последовательности длиной от 15 до 30 аминокислотных остатков, которая содержит много аминокислот с гидрофобными радикалами и обеспечивает прохождение белка через липидный бислой мембран. Некоторые из этих белков для дальнейшего транспорта упаковываются аппаратом Гольджи в секреторные гранулы.
Посттрансляционные модификации полипептидной цепи.Полипептидные цепи могут подвергаться структурным модификациям, либо будучи ещё связанными с рибосомами, либо после завершения синтеза. Эти конформационные и структурные изменения полипептидных цепей получили название посттрансляционных изменений. Они включают удаление части полипептидной цепи, ковалентное присоединение одного или нескольких низкомолекулярных лигандов, приобретение белком нативной конформации. Многие модификации осуществляются в ЭР. Здесь происходят фолдинг полипептидных цепейи формирование уникальной третичной или четвертичной структуры белков. Причём для поддержания нативной конформации молекул огромное значение имеет правильное формирование дисульфидных связей.
Частичный протеолиз. Многие белки, секретируемые из клеток, первоначально синтезируются в виде молекул-предшественников, функционально неактивных. Удаление части полипептидной цепи специфическими эндопротеазами приводит к образованию активных молекул. Некоторые белки-предшественники расщепляются в ЭР или аппарате Гольджи, другие - после секреции. Так, неактивные предшественники секретируемых ферментов - зимогены - образуют активный фермент после расщепления по определённым участкам молекулы: зимоген панкреатической железы трипсиноген превращается в активный трипсин после секреции в тонкий кишечник. Наглядным примером последовательного двухстадийного протеолиза служит образование активных форм пептидных гормонов (например, инсулина или глюкагона) из препрогормонов. Первоначально N-концевой сигнальный пептид молекулы-предшественника удаляется в ЭР в процессе синтеза белка и образуется неактивный прогормон. Затем прогормон в секреторных гранулах, формирующихся в аппарате Гольджи, подвергается действию эндо- и/или экзопротеаз и превращается в активный гормон.
Ковалентныемодификации. Структурные белки и ферменты могут активироваться или инактивироваться в результате присоединения различных химических групп: фосфатных, ацильных, метальных, олигосахаридных и некоторых других.
· Фосфорилирование белков осуществляется по гидроксильным группам серина, треонина и, реже, тирозина ферментами из группы протеинкиназ, тогда как дефосфорилирование катализируют гидролитические ферменты фосфопротеинфосфатазы.
· Гликозилирование. Белки, входящие в состав плазматических мембран или секретирующиеся из клеток, подвергаются гликозилированию. Углеводные цепи присоединяются то гидроксильным группам серина или треонина (О-гликозилирование) либо аспарагина (N-гликозилирование). Последовательное наращивание углеводного фрагмента происходит в ЭР и аппарате Гольджи.Многочисленным модификациям подвергаются боковые радикалы некоторых аминокислот: в тиреоглобулине йодируются остатки тирозина; в факторах свёртывания крови карбоксилируются остатки глутамата; в ЭР фибробластов гидроксилируются остатки пролина и лизина в цепях тропоколлагена.
110. Адаптивная регуляция генов у про- и эукариотов. Теория оперона. Функционирование оперонов.
Регуляция активности генов у прокариотов. Исследования на клетках Е. coli позволили установить, что у бактерий существуют ферменты 3 типов:
· конститутивные, присутствующие в клетках в постоянных количествах независимо от метаболического состояния организма (например, ферменты гликолиза);
· индуцируемые, их концентрация в обычных условиях мала, но может возрастать в 100Q раз и более, если, например, в среду культивирования клеток добавить субстрат такого фермента;
· репрессируемые, т.е. ферменты метаболических путей, синтез которых прекращается при добавлении в среду выращивания конечного продукта этих путей.
Теория оперона
На основании генетических исследований индукции β-галактозидазы, участвующей в клетках Е. coli, в гидролитическом расщеплении лактозы, Франсуа Жакоб и Жак Моно в 1961 г. сформулировали гипотезу оперона, которая объясняла механизм контроля синтеза белков у прокариотов. В экспериментах гипотеза оперона получила полное подтверждение, а предложенный в ней тип регуляции стали называть контролем синтеза белка на уровне транскрипции, так как в этом случае изменение скорости синтеза белков осуществляется за счёт изменения скорости транскрипции генов, т.е. на стадии образования мРНК. У Е. coli, как и у других прокариотов, ДНК не отделена от цитоплазмы ядерной оболочкой. В процессе транскрипции образуются первичные транскрипты, не содержащие нитронов, а мРНК лишены "кэпа" и поли-А-конца. Синтез белка начинается до того, как заканчивается синтез его матрицы, т.е. транскрипция и трансляция протекают почти одновременно. Исходя из размера генома (4×106 пар нуклеотидов), каждая клетка Е. coli содержит информацию о нескольких тысячах белков. Но при нормальных условиях роста она синтезирует около 600-800 различных белков, а это означает, что многие гены не транскрибируются, т.е. неактивны. Гены белков, функции которых в метаболических процессах тесно связаны, часто в геноме группируются вместе в структурные единицы (опероны). Согласно теории Жакоба и Моно, оперонами называют участки молекулы ДНК, которые содержат информацию о группе функционально взаимосвязанных структурных белков, и регуляторную зону, контролирующую транскрипцию этих генов. Структурные гены оперона экспрессируются согласованно, либо все они транскрибируются, и тогда оперон активен, либо ни один из генов не "прочитывается", и тогда оперон неактивен. Когда оперон активен и все его гены транскрибируются, то синтезируется полицистронная мРНК, служащая матрицей для синтеза всех белков этого оперона. Транскрипция структурных генов зависит от способности РНК-полимеразы присоединяться к промотору, расположенному на 5'-конце оперона перед структурными генами. Связывание РНК-полимеразы с промотором зависит от присутствия белка-репрессора на смежном с промотором участке, который называют "оператор". Белок-репрессор синтезируется в клетке с постоянной скоростью и имеет сродство к операторному участку. Структурно участки промотора и оператора частично перекрываются, поэтому присоединение белка-репрессора к оператору создаёт стерическое препятствие для присоединения РНК-полимеразы. Большинство механизмов регуляции синтеза белков направлено на изменение скорости связывания РНК-полимеразы с промотором, влияя таким образом на этап инициации транскрипции. Гены, осуществляющие синтез регуяяторных белков, могут быть удалены от оперона, транскрипцию которого они контролируют.
Не нашли, что искали? Воспользуйтесь поиском: