
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Лабораторна робота № 8
Лабораторна робота №44
Вивчення серіальних закономірностей в спектрі випромінювання водню і визначення сталої Планка
Мета роботи
Експериментально дослідити видиму частину спектра випромінювання атомів водню, за результатами вимірювань розрахувати сталу Планка
Для виконання лабораторної роботи студенту попередньо необхідно: знати серіальні закономірності формування спектра випромінювання атома водню та вміти їх пояснити
за теорією Бора (§4.1)
Прилади і матеріали
Монохроматор типу УМ–2, неонова лампочка, прилад СПЕКТР–1
Теоретичний відомості і опис установки
Як відомо спектр кожного газу складається з окремих спектральних ліній або груп (серій) близько розташованих ліній. Найбільш вивченим є спектр атома водню. Частоти випромінювання атома водню можна описати узагальненою формулою Бальмера у вигляді (4.4):
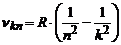 , (1)
, (1)
де  - частота випромінювання атома водню при його переході з
- частота випромінювання атома водню при його переході з  -го енергетичного рівня на
-го енергетичного рівня на  -й енергетичний рівень;
-й енергетичний рівень;  - стала Рідберга;
- стала Рідберга;  і
і  - цілі числа (
- цілі числа ( , а
, а  набуває значень
набуває значень
 і т.д.).
і т.д.).
Стала Рідберга  у формулі (1) визначається співвідношенням (4.7) (див. §4.1)
у формулі (1) визначається співвідношенням (4.7) (див. §4.1)
 , (2)
, (2)
де  - порядковий номер атома водню (
- порядковий номер атома водню ( =1); m= 9,11·10-31 кг – маса електрона; е =1,6·10-19 Кл – заряд електрона;
=1); m= 9,11·10-31 кг – маса електрона; е =1,6·10-19 Кл – заряд електрона; 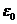 =8,85·10-12 Ф/м – електрична стала; с= 3·108 м/с – швидкість світла у вакуумі;
=8,85·10-12 Ф/м – електрична стала; с= 3·108 м/с – швидкість світла у вакуумі;  - стала Планка.
- стала Планка.
Кожному значенню  в (1) відповідає серія спектральних ліній. Для видимої частини спектра атома водню
в (1) відповідає серія спектральних ліній. Для видимої частини спектра атома водню  =2.
=2.
Формулу (1) з урахуванням (2) можна записати таким чином:
 . (3)
. (3)
Виражаючи частоту випромінювання  через довжину хвилі
через довжину хвилі 
 з (3) одержуємо вираз для визначення сталої Планка:
з (3) одержуємо вираз для визначення сталої Планка:
 . (4)
. (4)
З врахуванням того, що для атома водню  =1 вираз (4) перепишемо у вигляді
=1 вираз (4) перепишемо у вигляді
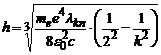 . (5)
. (5)
Перехід атомів газу із основного стану в збуджений легко здійснити за допомогою електричного розряду в розрідженому газі. Перехід атомів із збудженого стану в основний проходить спонтанно (самовільно) з випромінюванням ліній усіх серій.
В даній лабораторній роботі визначають наступні лінії в спектрі випромінювання водню, які лежать у видимій частині спектру і становлять 400-600 нм:
· червону лінію  , (
, ( = 3);
= 3);
· зелено-голубу лінію  , (
, ( = 4);
= 4);
· фіолетово − синю лінію  , (
, ( = 5);
= 5);
· фіолетову лінію  , (
, ( = 6).
= 6).
Експериментальна установка зібрана на основі монохроматора УМ–2, який використовується як спектроскоп. Оптична схема установки наведена на рис. 1.

Рис. 1
1 − воднева газорозрядна трубка; 2 − блок живлення трубки; 3 – збиральна лінза; 4 − вхідна щілина;
5 − об’єктив коліматора; 6 − дисперсійна призма; 7 − об’єктив зорової труби; 8 − візир; 9 − окуляр;
10 – захисний кожух неонової лампочки; 11 - неонова лампочка.
На вхідну щілину 4 монохроматора направляють світло від неонової лампочки 11 в кожусі 10 або газорозрядної водневої трубки 1 пристрою СПЕКТР –1.
Загальний вигляд установки зображений на рис. 2.

Рис. 2
1 - монохроматор; 2- воднева газорозрядна трубка в захисному кожусі; 3 - блок живлення трубки;
4 - неонова лампочка в захисному кожусі; 5 - барабан довжин хвиль монохроматора;
6 і 7 - регулювальні гвинти окуляра монохроматора; 8 - окуляр.
Послідовність виконання роботи
ЗАВДАННЯ 1. Градуювання монохроматора
Для цього (див.рис.2):
1. Розмістити близько до вхідної щілини монохроматора 1 неонову лампочку 4, яка розміщена в захисному кожусі, і увімкнути її в мережу 220 В.
2. Встановити ширину вхідної щілину монохроматора ~ 0,22 мм.
3. Досягнути чітке зображення спектральних ліній в окулярі 8 монохроматора за допомогою
регулювальних гвинтів 6 та 7, а оптимальну ширину спектральних ліній – незначним регулюванням ширини вхідної щілини монохроматора.
4. Плавно обертаючи барабан 5 довжин хвиль монохроматора, суміщати з візиром монохроматора видимі в окуляр 8 спектральні лінії випромінювання неону та встановлювати відповідність між значеннями  і відносними поділками
і відносними поділками  шкали барабана довжин хвиль (для спектру випромінювання неону значення l вказані на робочому місці).
шкали барабана довжин хвиль (для спектру випромінювання неону значення l вказані на робочому місці).
5. Результати вимірювань записати в таблицю 1.
6. Вимкнути з мережі 220 В неонову лампочку і зняти її з оптичної лави.
7. Побудувати графік залежності  (графік градуювання монохроматора), відкладаючи по осі Х відносні поділки
(графік градуювання монохроматора), відкладаючи по осі Х відносні поділки  шкали барабана 5 довжин хвиль, а по осі Y − довжини хвиль
шкали барабана 5 довжин хвиль, а по осі Y − довжини хвиль  відповідних ліній.
відповідних ліній.
| l, Å | |||||||||
| n, відн. од. |
Таблиця 1
ЗАВДАННЯ 2. Визначення довжин хвиль спектральних ліній випромінювання атомів
водню та сталої Планка
1. Розмістити на місці неонової лампочки прилад СПЕКТР – 1.
2. Увімкнути прилад СПЕКТР–1 в мережу 220 В і встановити перемикач на ньому в положення “H2”.
3. Переміщаючи окуляр 8 зорової труби монохроматора 1 за допомогою регулювальних гвинтів 6 і 7 добитися чіткого зображення ліній випромінювання атомів водню в окулярі.
4. Дивлячись в окуляр монохроматора, встановлювати почергово поворотом барабана 5 довжин хвиль спектральні лінії випромінювання водню навпроти візира монохроматора і проводити відліки, що відповідають цим лініям, за шкалою барабана монохроматора. Візуальний пошук ліній необхідно починати з найбільш інтенсивної червоної  лінії. Одержані результати записати в таблицю 2.
лінії. Одержані результати записати в таблицю 2.
УВАГА! В спектрі водневої трубки поряд з лініями атомного спектру спостерігається спектр молекулярного водню.
Таблиця 2
| Колір і індекс лінії | n, відн.од. | λ, нм | Квантові числа | h·1034, Дж·с | Δ h·1034, Дж·с | δh, 100% | |
| n | k | ||||||
| Яскраво−червона, Ha | |||||||
| Зелено−голуба, Hb | |||||||
| Фіолетово−синя, Hg. | |||||||
Фіолетова,

| |||||||
| Сер. | хххх | хххх | хххх | хххх |
5. Користуючись кривою градуювання монохроматора визначити довжини хвиль кожної з ліній випромінювання водню.
6. Розрахувати за формулою (5) сталу Планка, використовуючи довжини 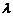 хвиль ліній випромінювання водню:
хвиль ліній випромінювання водню:  ,
,  ,
,  і
і  .
.
7. Дані, які одержані в п.п. 5−6, записати в таблицю 2.
8. Проаналізуйте одержані результати і зробіть висновки.
Контрольні запитання
- Які серії випромінювання, крім серії Бальмера, ще має спектр випромінювання атом водню?
- Який фізичний зміст мають квантові числа
 і
і  у формулі (1)?
у формулі (1)? - Сформулюйте постулати Бора. Як з їх допомогою пояснити лінійчатий характер спектру випромінювання атома водню?
- Які фізичні величини необхідно знати для того, щоб розрахувати постійну Планка в даній роботі?
- Знайдіть частоту обертання електрона в атомі водню.
- Виведіть формулу, яка визначає повну енергію електрона в атомі водню.
Лабораторна робота № 8
ВИЗНАЧЕННЯ РЕЗОНАНСНОГО ПОТЕНЦІАЛУ збудження атомів гелію методом Франка і Герца
Мета роботи
Визначити резонансний потенціал та частоту резонансного випромінювання атомів гелію, розрахувати величину поперечного перерізу електронно – атомних зіткнень
Для виконання лабораторної роботи студенту попередньо необхідно: знати серіальні закономірності у формуванні спектра випромінювання атома водню та вміти їх пояснити за теорією Бора (§4.1), бути ознайомленим з методикою, яку використовували Д.Франк і Г. Герц для ввизначення резонансного потенціалу збудження атомів (§4.2)
Прилади і обладнання
Трьохелектродна лампа, яка заповнена інертним газом – гелієм, джерело живлення типу ПСИП-500 анодної та сіткової ділянок кіл установки, автотрансформатор, випрямляч струму типу ВСА-6А, амперметр катодного кола, мікроамперметр анодного кола, вольтметри
Теоретичні відомості та опис установки
Різниця потенціалів, пройшовши яку електрон зазнає непружного зіткнення з атомом газу, внаслідок чого атом переходить основного стану в перший збуджений стан, називають резонансним потенціалом. Потенціал, при якому атом переходить з основного стану в другий збуджений стан називають другим, і т.д.
Атоми, які отримують при непружному ударі з електроном енергію  , переходять у збуджений стан і, повертаючись в основний, випромінюють світловий квант з частотою
, переходять у збуджений стан і, повертаючись в основний, випромінюють світловий квант з частотою
 , (1)
, (1)
де  – стала Планка.
– стала Планка.
В даній лабораторній роботі визначають резонансний потенціал для атомів гелію. Для цього використовується установка, яка відповідає досліду Д. Франка і Г. Герца. Схематично така установка зображена на рис.1.
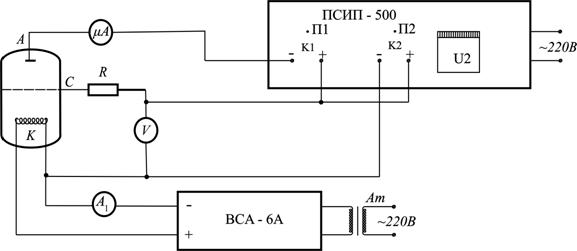
Рис. 1
Основною складовою експериментальної установки є трьохелектродна лампа, яка складається з скляного балона, всередині якого розміщені анод А, катод К і керуюча сітка С. Лампа заповнена хімічно чистим гелієм при тиску р ~  .
.
Розжарювання катода лампи – джерела електронів здійснюється за допомогою автотрансформатора Ат, увімкненого в мережу 220 В (рис. 1). Сила катодного струму вимірюється амперметром  . Анод А лампи відносно сітки С знаходиться під невеликою від’ємною напругою Ua, яка створює слабке гальмівне електричне поле. На сітку відносно катода подається прискорююча напруга – Uc , яка контролюється вольтметром V. Анодний струм
. Анод А лампи відносно сітки С знаходиться під невеликою від’ємною напругою Ua, яка створює слабке гальмівне електричне поле. На сітку відносно катода подається прискорююча напруга – Uc , яка контролюється вольтметром V. Анодний струм  вимірюють мікроамперметром μА. В коло катод–сітка включено опір R для обмеження струму у випадку виникнення газового розряду в лампі.
вимірюють мікроамперметром μА. В коло катод–сітка включено опір R для обмеження струму у випадку виникнення газового розряду в лампі.
Для визначення резонансного потенціалу атомів гелію, експериментально отримують вольт–амперну характеристику лампи  , тобто залежність анодного струму Іа від сіткової напруги при постійній анодній напрузі
, тобто залежність анодного струму Іа від сіткової напруги при постійній анодній напрузі 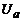 . Оскільки кількість електронів, які досягають анода, визначає величину електричного струму, що протікає в анодному колі лампи, то, очевидно, за зміною анодного струму можна судити про значення першого та інших потенціалів збудження і характер зіткнень електронів з атомами гелію. Таким потенціалам будуть відповідати максимуми на графіку
. Оскільки кількість електронів, які досягають анода, визначає величину електричного струму, що протікає в анодному колі лампи, то, очевидно, за зміною анодного струму можна судити про значення першого та інших потенціалів збудження і характер зіткнень електронів з атомами гелію. Таким потенціалам будуть відповідати максимуми на графіку  .
.
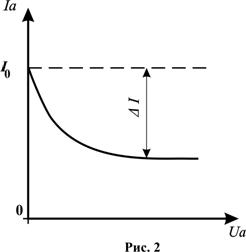
Для розрахунку поперечного перерізу  електронно−атомних зіткнень можна використати експериментальну залежність величини анодного струму
електронно−атомних зіткнень можна використати експериментальну залежність величини анодного струму  від затримуючої напруги
від затримуючої напруги 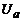 (
( ) при
) при  =const (рис.2). З рис.2 визначають значення
=const (рис.2). З рис.2 визначають значення 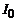 та
та 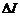 , де
, де 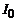 – початковий анодний струм (при Ua =0), а
– початковий анодний струм (при Ua =0), а 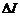 – величина, яка визначається числом електронів, які зазнали непружного зіткнення з атомами гелію в об’ємі V між сіткою та анодом.
– величина, яка визначається числом електронів, які зазнали непружного зіткнення з атомами гелію в об’ємі V між сіткою та анодом.
Теорія зіткнень для визначення значення 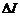 дає співвідношення:
дає співвідношення:
 , (2)
, (2)
де е–- заряд електрона;  – концентрація атомів газу; п – концентрація електронів;
– концентрація атомів газу; п – концентрація електронів;  – швидкість електрона на ділянці лампи сітка–анод;
– швидкість електрона на ділянці лампи сітка–анод; 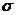 – поперечний переріз непружного зіткнення електрона з атомом; V – об’єм між сіткою і анодом.
– поперечний переріз непружного зіткнення електрона з атомом; V – об’єм між сіткою і анодом.
 , (3)
, (3)
де S – площа сітки; d = 5·10 –3 м – відстань між сіткою та анодом.
З деяким наближенням потік електронів можна оцінити таким чином:
 . (4)
. (4)
Співвідношення, що визначає величину поперечного перерізу  непружного удару електрона з атомом гелію одержано з (2), (3) та (4):
непружного удару електрона з атомом гелію одержано з (2), (3) та (4):
 . (5)
. (5)
Концентрацію атомів газу можна знайти з рівняння:
 ,
,
де k – стала Больцмана ( ); Т – температура катода (~ 2000 K); р – тиск гелію в лампі.
); Т – температура катода (~ 2000 K); р – тиск гелію в лампі.
Таким чином, кінцева формула для визначення поперечного перерізу непружного удару електрона з атомом гелію
 . (6)
. (6)
Загальний вигляд установки наведено на рис. 3

Рис. 3
1 - джерело живлення анодної та сіткової ділянок електричних кіл (ПСИП-50);
2 - вимірювальний блок, до складу якого входять амперметр катодного кола, вольтметр анодного кола, вольтметр кола сітки; 3 - лампа, яка наповнена гелієм, в захисному кожусі; 4 - випрямляч струму типу ВСА-6А; 5 - автотрансформатор; 6 - мікроамперметр анодного кола
Послідовність виконання роботи
- Ознайомитися з приладами, які входять до складу лабораторної установки.
- Встановити регулятор напруги на автотрансформаторі 5 в нульове положення і увімкнути його в мережу 220 В. УВАГА! Без дозволу викладача не вмикати.
- Перевести ручки потенціометрів П1 і П2 на джерелі живлення ПСИП-500 в крайнє ліве положення.
- Увімкнути ПСИП-500 в мережу 220 В.
- Регулятором напруги на автотрансформаторі установити в колі катода лампи силу струму, вказану на робочому місці. УВАГА! Під час експерименту стежити, щоб сила струму в катодному колі залишалася сталою.
- Прогрівши лампу протягом 2–3 хв, встановити потенціометром П 1 анодну напругу
 , яка вказана на робочому місці, і вимірювати величину анодного струму
, яка вказана на робочому місці, і вимірювати величину анодного струму  , змінюючи потенціометром П 2 напругу
, змінюючи потенціометром П 2 напругу  на сітці лампи від 0 до 20 В з кроком 0,5 В. Результати вимірювань записати в таблицю 1.
на сітці лампи від 0 до 20 В з кроком 0,5 В. Результати вимірювань записати в таблицю 1.
Таблиця 1
| № п/п | Uc, В | Іа,мкА | Ік, А | Ua, В | Резонансний потенціал Uр, В |
| 0,5 | |||||
| 1,0 | |||||
| ... | … | ||||
- Побудувати графік залежності
 . З графіка визначити значення резонансного потенціалу
. З графіка визначити значення резонансного потенціалу  атома гелію.
атома гелію. - За формулою (1) обчислити довжину хвилі фотонів, що випромінюються атомом гелію. Отримане значення довжини хвилі випромінювання записати в таблицю 2.
- Встановити потенціометром П 2 постійну напругу
 на сітці, вказану на робочому місці, та вимірювати величини анодного струму
на сітці, вказану на робочому місці, та вимірювати величини анодного струму  , змінюючи потенціометром П 1 анодну напругу
, змінюючи потенціометром П 1 анодну напругу  від 0 до 11 В з кроком 1 В. Результати вимірювань записати в таблицю 2.
від 0 до 11 В з кроком 1 В. Результати вимірювань записати в таблицю 2.
Таблиця 2
| № п/п | Ік,А | Uc,В | Ua,В | Іа, мкА | 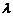 , нм , нм
|  ,% ,%
|
| ... | ... | |||||
- Побудувати графік залежності
 і з цього ж графіка визначити значення
і з цього ж графіка визначити значення  та
та 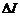 . За формулою (6) розрахувати величину поперечного перерізу
. За формулою (6) розрахувати величину поперечного перерізу  непружного зіткнення електрона з атомом гелію.
непружного зіткнення електрона з атомом гелію. - Проаналізувати одержані результати та зробити висновки.
Контрольні запитання
- В чому полягає фізичну суть пружних і непружних ударів електронів з атомами газів?
- Який фізичний факт підтверджує дослід Франка і Герца?
- Поясніть характер зміни вольт-амперної характеристики в досліді Франка і Герца.
- Яким чином, знаючи енергію переходу атома з основного рівня на резонансний, можна визначити
 – частоту резонансного випромінювання.
– частоту резонансного випромінювання. - Вивести робочу формулу для визначення поперечного перерізу
 непружного удару електрона з атомами газів.
непружного удару електрона з атомами газів. - Як пояснюється свічення газів в електричному розряді?
Не нашли, что искали? Воспользуйтесь поиском: