
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Свободная энергия Гиббса и константа равновесия
Условием принципиальной осуществимости процесса, т.е. возможности самопроизвольного протекания реакции в прямом направлении является неравенство DG0 < 0.
Чем меньше DG0 нуля, тем дальше система от состояния равновесия и тем более она реакционноспособна. Любая реакция может протекать самопроизвольно только в направлении, приближающем систему к состоянию равновесия. Если в системе наступило истинное химическое равновесие, то дальнейшее изменение энергии Гиббса происходить не будет, т.е. DG0 = 0, тогда DH = T · DS - энтальпийный фактор равен энтропийному - термодинамическая концепция равновесия.
Термодинамика дает важное соотношение между стандартной свободной энергией и константой равновесия, названное изотермой химической реакции:
DG0 = -R · T · ln K = -2,3 · R · T · lg K
При 298К(250С) это уравнение преобразуется к виду:
DG0 = -5,69 · lg K.
Как видно из этих уравнений отрицательный знак DG0 возможен только в случае, если lgK > 0, т.е. К > 1, а положительный – если lgK < 0, т.е. К < 1.
Это значит, что при отрицательных значениях DG0 равновесие смещено в направлении прямой реакции и выход продуктов реакции сравнительно велик, при положительном знаке DG0 равновесие смещено в сторону обратной реакции и выход продуктов прямой реакции сравнительно мал.
Знак DG0 указывает на возможность или невозможность протекания реакции только в стандартных условиях. Чем значительнее убыль энергии Гиббса, тем больше константа равновесия.
Константа равновесия связана с энтальпией системы. Из уравнения Аррениуса
k = A · e-Eа /R ·T
В случае химического равновесия:
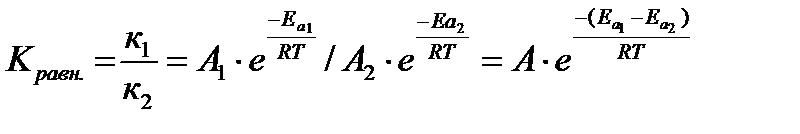
Разность энергий активации прямой и обратной реакций равняется изменению энтальпии в результате взаимодействия Еа1 - Еа2 = DН, тогда
Кравн = А · е - DН /R·T –уравнение Вант - Гоффа,
или в логарифмической форме
lnK = lnA - DH/R · T
Изменение температуры влияет на величину константы равновесия.
Не нашли, что искали? Воспользуйтесь поиском: