
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ. Задание 1. Напишите схему мицеллы коллоидного раствора, полученного обменной реакцией ВаCl2 и К2СО3 (в избытке).
Задание 1. Напишите схему мицеллы коллоидного раствора, полученного обменной реакцией ВаCl2 и К2СО3 (в избытке).
Решение:
ВаCl2 + К2СО3 → ВаСО3↓ + 2КCl
Ядро гранулы: m[ВаСО3]. Так как К2СО3 в избытке, потенциалопределяющими ионами служат анионы СО3 2–, а противоионами катионы К+.
Формула мицеллы карбоната бария при избытке К2СО3:
{m [ВаСО3] n СО32– 2(n-x) К+}2x– 2xК+
Задание 2. Золь сульфата свинца получен при сливании равных объемов 0,001М раствора сульфата калия и 0,02М раствора нитрата свинца. Напишите формулу мицеллы.
Решение:
Pb(NO3)2 + K2SO4 → PbSO4↓ +2KNO3
1 моль 1 моль
Концентрация раствора Pb(NO3)2 больше, чем K2SO4, поэтому Pb(NO3)2 в избытке, т.е. ионы Pb2+ в избытке и являются потенциалопределяющими. Частицы золя будут заряжены положительно.
Формула мицеллы: {m[PbSO4] nPb2+ 2(n – x)NO3–}2x+ ∙ 2xNO3–
РАСТВОРЫ
Раствор - это гомогенная система, состоящая из растворителя, растворенного вещества и продуктов их взаимодействия.
Например: водный раствор H2SO4. Растворитель - Н2О, растворенное вещество - H2SO4, продукты взаимодействия растворителя с растворенным веществом – Н+ (Н3О+ – ион оксония), HSO4-, SO42-, гидраты H2SO4∙Н2О, H2SO4∙2Н2О, H2SO4∙4Н2О.
Каждый из компонентов распределён в другом в виде атомов, молекул или ионов (размер частиц менее 1 нм или 10-9м).
По агрегатному состоянию растворы делятся:
1. газообразные растворы, например воздух (раствор кислорода, паров воды, углекислого газа СО2 и благородных газов в азоте);
2. твердые растворы, например сплавы металлов (медные: Cu – Zn, Cu – Cd, Cu – Ni);
3. жидкие растворы в свою очередь делятся:
- растворы твердых веществ в жидкостях, например соль, сахар в воде;
- растворы газообразных веществ в жидкостях: соляная кислота, нашатырный спирт;
- растворы жидких веществ в жидкостях: уксус, водка (спирт + вода).
Растворенным веществом при одинаковом агрегатном состоянии компонентов обычно считаются компонент, находящийся в недостатке, в то время как компонент, находящийся в избытке, считается растворителем. При разных агрегатных состояниях компонентов раствора растворителем обычно считается компонент, агрегатное состояние которого совпадает с агрегатным состоянием раствора.
По относительным количествам растворенного вещества и растворители растворы бывают: разбавленные и концентрированные.
Раствор, в котором данное вещество при данной температуре больше не растворяется, называют насыщенным. Р аствор, в котором еще можно растворить дополнительное количество данного вещества, называют ненасыщенным. Пересыщенный раствор — раствор, содержащий при данных условиях больше растворённого вещества, чем в насыщенном растворе, избыток вещества легко выпадает в осадок. Обычно пересыщенный раствор получают охлаждением раствора, насыщенного при более высокой температуре (пересыщение).
Растворимость выражается концентрацией растворённого вещества в его насыщенном растворе при определенной температуре (обычно 20оС) и может быть выражена в г/100 г или 1л растворителя (коэффициент растворимости вещества, Р), моль/л (молярная растворимость, s). Табличные величины. Р(NaCl) = 36г/100г воды или 360г/1 л воды, s(NaCl) = 6,154 моль/л.
s(моль/л) = Р(г/л)/Мраств. в-ва
Теория растворов была была создана и обоснована Д.И. Менделеевым в 1887г. Согласно этой теории растворение – сложный физико-химический процесс взаимодействия атомов (молекул) растворителя и растворённого вещества. При растворении межфазная граница исчезает, при этом многие физические свойства раствора (например, плотность, вязкость, иногда — цвет) меняются. В случае химического взаимодействия растворителя и растворённого вещества сильно меняются и химические свойства — например, при растворении газа хлороводорода в воде образуется жидкая соляная кислота. Растворение сопровождается изменением энтальпии (∆Н) и энтропии (∆S). Процесс растворения может быть экзотермическим (∆Н<0) и эндотермическим (∆Н>0). Увеличение энтропии сопровождает растворение твёрдых веществ (∆S>0), а её уменьшение происходит при растворении газов (∆S<0). Продукты взаимодействия растворителя и растворенного вещества называются – сольваты (если растворитель вода – гидраты). Гидраты, выделенные из водных растворов называются – кристаллогидраты ( CuSO4∙5Н2О - медный купорос, Na2SO4∙10H2O - глауберова соль, CaSO4∙H2O- гипс).
Содержание растворенного вещества в растворе может быть выражено либо безразмерными единицами – долями, либо величинами размерными – концентрациями.
Основными способами выражения содержания растворенного вещества являются:
1. Массовая доля (ω) — отношение массы растворённого вещества (m1) к массе раствора (m). Массовая доля измеряется в долях или в процентах:
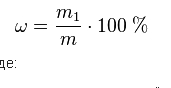
Например, 15% раствор хлорида натрия – это такой раствор, в 100 г которого содержится 15 г NaCl и 85 г воды.
2. Мольная доля (N i) - отношение числа молей данного вещества (n1) к общему числу молей всех веществ (n1, n2), имеющихся в растворе:
N1=n1/(n1+n2)
Безразмерная величина.
3. Молярная концентрация, или м олярность (СМ) – число моль (n1) растворенного вещества к объему раствора в литрах (V):
СМ= n1/V
или СМ= m1 /М1∙V
где m1 – масса растворенного вещества, М1 – молярная масса растворенного вещества.
Например, 2М H2SO4 обозначает раствор серной кислоты, в каждом литре которого содержится два моля H2SO4 (196 г) или См (H2SO4) = 2 моль/л.
4. Моляльная концентрация, или м оляльность(Сm) – отношение числа молей растворенного вещества (n1) к массе растворителя в килограммах (m2):
С m = n1/ m2
или С m = m1 /М1∙ m2
где m1 – масса растворенного вещества, М1 – молярная масса растворенного вещества.
Например, 2m H2SO4 обозначает раствор серной кислоты, в котором на 1 кг (1000 г) воды приходится два моля H2SO4 (196 г) или Сm(H2SO4) = 2 моль/кг.
5. Молярная концентрация эквивалентов, или эквивалентная концентрация, или нормальность (Сн, СN, N) – отношение числа эквивалентов (nэкв1) растворенного вещества к объему раствора в литрах (V):
СN= nэкв1/V
или СN= m1 /Мэкв1∙V
где m1 – масса растворенного вещества, Мэкв1 – молярная масса эквивалента растворенного вещества.
Например, 2н. H2SO4 обозначает раствор серной кислоты, в каждом литре которого содержится два эквивалента H2SO4 (98 г) или СN(H2SO4) = 2 моль/л.
Пользуясь растворами, концентрация которых выражена нормальностью, легко заранее рассчитать, в каких объемных отношениях они должны быть смешаны, чтобы растворенные вещества прореагировали без остатка:
СН1V1= СН2V2,
где СН1, СН2 – молярные концентрации эквивалента (моль) растворенного вещества 1 и 2 соответственно; V1, V2 – объемы растворов (л) 1 и 2 соответственно. Таким образом, объемы растворов реагирующих веществ обратно пропорциональны их нормальностям.
Не нашли, что искали? Воспользуйтесь поиском: