
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Электрическая схема электролиза. Законы Фарадея для электролиза. Приведите примеры применения электролиза.
Электролизом называется процесс выделения на электродах вещества, связанный с окислительно-восстановительными реакциями при прохождении тока через электролит.

Явление электролиза широко применяется в современной промышленности. В частности, электролиз является одним из способов промышленного получения алюминия, водорода, а также гидроксида натрия, хлора, хлорорганических соединений, диоксида марганца, пероксида водорода. Большое количество металлов извлекаются из руд и подвергаются переработке с помощью электролиза (электроэкстракция,электрорафинирование).
Также, электролиз является основным процессом, благодаря которому функционирует
химический источник тока.
Электролиз находит применение в очистке сточных вод (процессы электрокоагуляции, электроэкстракции, электрофлотации). Применяется для получения многих веществ (металлов, водорода, хлора и др.), при нанесении металлических покрытий (гальваностегия), воспроизведении формы предметов (гальванопластика).
Первый закон электролиза Фарадея: масса вещества, осаждённого на электроде при электролизе, прямо пропорциональна количеству электричества, переданного на этот электрод.
Фарадей установил, что масса m вещества, выделившегося на электроде, прямо пропорциональна электрическому заряду q, прошедшему через электролит: m=kq=kIt,
если через электролит пропускается в течение времени t постоянный ток с силой тока I. Коэффициент пропорциональности k называется электрохимическим эквивалентом вещества. Он численно равен массе вещества, выделившегося при прохождении через электролит единичного электрического заряда, и зависит от химической природы вещества.
Второй закон электролиза Фарадея: для данного количества электричества масса химического элемента, осаждённого на электроде, прямо пропорциональна эквивалентной массе элемента. Эквивалентной массой вещества является его молярная масса, делённая на целое число, зависящее от химической реакции, в которой участвует вещество.
Электрохимические эквиваленты различных веществ относятся, как их химические эквиваленты.
Химическим эквивалентом иона называется отношение молярной массы A иона к его валентности z. Поэтому электрохимический эквивалент:  ,
,
где F - постоянная Фарадея.
Задача 17
На рисунке ε=2 В, R1=60 Ом, R2=40 Ом, R3=R4=20 Ом и RG=100 Ом. Определите силу тока через гальванометр.
Дано:
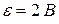




|

|
Решение.

По первому закону Кирхгофа для узла A имеем:  . (1)
. (1)
По первому закону Кирхгофа для узла C имеем:  . (2)
. (2)
По первому закону Кирхгофа для узла E имеем:  . (3)
. (3)
По первому закону Кирхгофа для узла F имеем:  . (4)
. (4)
По второму закону Кирхгофа для контура BDGHB имеем:  . (5)
. (5)
По второму закону Кирхгофа для контура AFGHA имеем:  . (6)
. (6)
По второму закону Кирхгофа для контура BCFEGHB имеем:  . (7)
. (7)
Подставляем (2) в (5):  .
.
Тогда, имеем:  (8).
(8).
Подставляем (4) в (6): 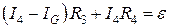 .
.
Тогда, имеем:  (9).
(9).
Подставляем (8) и (9) в (7):  ,
,
 ,
,
 ,
,
 .
.
Получаем,  .
.
Ответ.  , направлен в сторону, противоположную первоначально выбранной.
, направлен в сторону, противоположную первоначально выбранной.
Ответить на теоретические вопросы:
Не нашли, что искали? Воспользуйтесь поиском: