
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Элементарное строение атома
Согласно современным представлениям, атом является сложной системой.
Атом – это наименьшая, химически неделимая частица, являющаяся носителем химических свойств химического элемента. Атом состоит из положительно заряженного ядра и движущихся вокруг него электронов.
| Атом – электронейтральная система | |||||||||||
| Ядро | Электронная оболочка | ||||||||||


| |||||||||||
Нейтроны, 
  (общее число N) (общее число N)
| |||||||||||
Электроны,    (общее число Э = Z)
(общее число Э = Z)
|
Протоны, 1 
 (общее число Z) (общее число Z)
|
| Практически вся масса атома А = Z + N |
масса электрона
 заряд электрона
заряд электрона
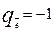
|


масса нейтрона
 = =  заряд нейтрона
заряд нейтрона
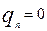
|
масса протона
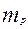 = = 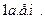 заряд протона
заряд протона

|
 | |||
 | |||
Схема 3.1. Характеристика строения атома
Ядра атомов состоят из элементарных частиц двух видов – протонов и нейтронов.
Протон – стабильная элементарная частица в составе атомного ядра с положительным зарядом, по абсолютной величине равным заряду электрона. Масса протона равна массе ядра атома легкого изотопа водорода 
Нейтрон – элементарная незаряженная частица в составе ядра атома, по массе равная массе протона.
Таким образом, заряд ядра атома определяется числом находящихся в нём протонов (Z). Сумма числа протонов Z и нейтронов N дает массу атома (А):
А = Z + N. (3.1.)
Вокруг ядра имеется электронная оболочка.
Электрон – элементарная отрицательная частица с массой, равной 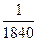 массы протона.
массы протона.
Число электронов в атоме (Э) равно значению положительного заряда ядра (Z), т.е. числу протонов в ядре. Поэтому атом в целом электронейтрален, (Э = Z = порядковый № элемента).
Пользуясь периодической системой Д.И.Менделеева (ПСЭ), можно определить точное число элементарных частиц в атоме. Например, элемент хлор имеет порядковый номер 17. массовое число (атомная масса) 35. Следовательно, в ядре 17 протонов и 18 нейтронов (35 – 17 = 18), вокруг ядра вращается 17 электронов.
В природе встречаются атомы одного химического элемента (с одинаковым зарядом ядра), но отличающиеся массовыми числами. Такие атомы называются изотопами. Изотопы есть почти у всех химических элементов. Массовое число элемента – это средняя величина массовых чисел всех его природных изотопов с учетом их распространенности. Например, элемент хлор имеет 2 изотопа:  – 75,43% и
– 75,43% и  – 24,57%. Следовательно, относительная масса атома хлора, приблизительно, равна:
– 24,57%. Следовательно, относительная масса атома хлора, приблизительно, равна:
35·0,7543 + 37·0,2457 = 35,49 а.е.м.
Таким образом, химический элемент – это атомы одного вида с одинаковым положительным зарядом ядра. Положение элемента в периодической системе определяется зарядом ядра его атома. Главной характеристикой атома, а значит, и элемента, является положительный заряд ядра.
Не нашли, что искали? Воспользуйтесь поиском: