
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Водородный показатель. Вода – слабый амфотерный электролит:
Вода – слабый амфотерный электролит:
Н2О ↔ Н+ + ОН-.
Количественно диссоциация воды описывается константой диссоциации:
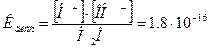 (при 220С) (7.11.)
(при 220С) (7.11.)
и ионным произведением воды:
 = 10-14. (7.12.)
= 10-14. (7.12.)
 Ионное произведение воды (Кв) – произведение концентрации ионов водорода на концентрацию гидроксильных ионов есть величина постоянная и при комнатной температуре равна 10-14.
Ионное произведение воды (Кв) – произведение концентрации ионов водорода на концентрацию гидроксильных ионов есть величина постоянная и при комнатной температуре равна 10-14.
В чистой дистиллированной воде:
 .
.
При избытке ионов водорода в растворе [H+] > 10-7. В щелочной среде [H+] < 10-7. Причём, как бы ни менялись [H+] и [ОH-], их произведение всегда остаётся 10-14.
Чтобы не писать числа с показателем степени, кислотность раствора часто выражают через водородный показатель.
Водородный показатель (рН) – отрицательный десятичный логарифм концентрации ионов водорода:
 . (7.13.)
. (7.13.)
В кислых растворах рН < 7, в нейтральных рН = 7, в щелочных рН > 7.
Зная концентрацию одного из ионов воды в растворе, всегда можно вычислить концентрацию другого иона, используя значение ионного произведения воды (7.12.).
Зная концентрацию раствора кислоты или основания можно рассчитать рН раствора (7.12).
Зная рН раствора, можно по уравнению:
[H+] = 10-рН (7.14.)
вычислить концентрацию ионов водорода.

Гидролиз солей
Часто при растворении некоторых солей в воде происходит не только электролитическая диссоциация их, но и реакция ионного обмена между растворителем водой, которая является слабым электролитом, с одной стороны, и ионами соли (сильным электролитом), с другой стороны. Доказательством такого взаимодействия является тот факт, что растворы этих солей имеют кислую или щелочную реакцию, при отсутствии в составе последних водородных или гидроксильных ионов.
 Гидролиз солей – это взаимодействие ионов соли в растворе с молекулами воды, в результате которого образуется слабый электролит (малодиссоциирующие молекулы или ионы) и возможно накопление одного из ионов воды (Н+ или ОН-).
Гидролиз солей – это взаимодействие ионов соли в растворе с молекулами воды, в результате которого образуется слабый электролит (малодиссоциирующие молекулы или ионы) и возможно накопление одного из ионов воды (Н+ или ОН-).
С точки зрения электролитической диссоциации, все соли по своей природе, делятся на четыре группы:
1. Соли, образованные сильным основанием и сильной кислотой.
2. Соли, образованные сильным основанием и слабой кислотой.
3. Соли, образованные слабым основанием и сильной кислотой.
4. Соли, образованные слабым основанием и слабой кислотой.
Первая группа солей гидролизу не подвергается
Не нашли, что искали? Воспользуйтесь поиском: