
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Газдардың сәуле шығаруындағы сериалық заңдары
Жанып жатқан пештің қасында тұрғанда, біз жылуды сеземіз.Күн энергиясы Жерге беріледі. Қызып тұрған үтікке немесе оттың жалынына қолымызды жақындатсак, біз тіпті төменнен де (яғни салқын ауа ағып келіп жаткан жерде) «қызуды» сеземіз.
Жоғарыда аталған жағдайлардың барлығында жылу қалай беріледі? Жылуөткізгіштік жолымен берілмейтіндігі анық. Себебі ауа — нашар жылуөткізгіш. Сондай-ақ конвекция жолымен де емес, өйткені конвекциялық ағындар үнемі жоғары көтеріледі.
Бұл сұрақтарға жауап беру үшін жылу қабылдағышты пайдаланып, тәжірибе жасап көрейік (30-сурет).
Жылу қабылдағыш дегеніміз — бір жағы қара, екінші жағы жылтыр жалпақ дөңгелек қорапша. Оның ішінде қыздырғанда ұлғайып, саңылау арқылы сыртқа шыға алатын ауа болады.
Жылу қабылдағышты сүйықтық манометрмен жалғастырып және оны өте қатты қызған гір тастың жанына орналастырамыз (31-сурет). Біз манометрдегі сұйық бағанының орын ауыстырғанын байқаймыз. Бұл гір тастан жылу берілу барысында жылу қабылдағыштағы ауаның қызғанын және ұлғайғанын көрсетеді.
Егер қызған гір тасы мен жылу қабылдағыш аралығына экран, мысалы, қағаз парағын орналастырсақ, онда қыздыру тоқтап қалады.
Бұл жағдайда, жылу қызған денеден жылу қабылдағышқа көрінбейтін жылу сәулелерінің көмегімен беріледі. Жылу түрі — сәулелену немесе сәулелік жылу алмасу деп аталады. 9-сыныпта мұндай сәулелерге радиотолқындар, ультракүлгін, рентген, жарық түріндегі электргниттік толкындар жататынын оқып-үйренетін боласыңдар.Бұл келтірілген тәжірибеде қыздырылған гір тасы сәуле
шығарады, яғни өзінің ішкі энергиясын береді, ал жылу қабылдағыш қыздырылған гір тастан бөлінетін энергияны қабылдайды немесе жұтады да қызады.
• Сәуле шығару (сәулелік жылу алмасу) деп электрмагниттік толқындар көмегімен бір денеден екінші денеге энергияның берілу процесін айтамыз.
• Сәулелену энергиясының дененің ішкі энергиясына айналуын жұтылу деп атайды.
Сәулеленудің қарқындылығы неге байланысты?
Жылу қабылдағышты бірдей қашықтықта кезектестіріп ыстық суы (40°С) бар стақанға, спирт шам жалынына (500°С — 700°С) және қыздыру шамына (1500°С) жақындатамыз. Соңғы жағдайда,
жылу қабылдағыштағы сұйық ең көп ығысады. Бұдан дене температурасы артқан сайын сәулелену қарқындылыгы жоғары болады деген қорытынды шығады.
Сәулелену арқылы энергияның берілуі — ортаны қажет етпейді: жылу сәулелері вакуум арқылы да таралады.
Жерге Күннен келетін энергия да сәулелену арқылы жетеді.
Әр секунд сайын Жер шамамен 1014 кДж энергия алады. Жер Күннен келетін энергияның бір бөлігін жұтқанда, Жердің ішкі энергиясының ұлғаятындығы және соған сәйкес температураның
артатындығы байқалады. Күннен келетін сәулелену тек Жердің бетін ғана емес, оның атмосферасын да, теңіздер мен мүхиттарды да қыздырады.
Ыстық кезде, біз күн сөулесінен қорғану үшін басымызға қалпақ киеміз. Күн сәулесі, әсіресе денеміздің қара түсті киіммен жабылған түстарын өте қатты қыздыратынын еске түсірейік. Бұл сәуленің денелерге біркелкі түспейтінін және беттің күйіне байланысты оларды біркелкі қыздырмайтындығын білдіреді. Бұған көз жеткізу үшін қызған денеге жылу қабылдағыштың әуелі қарайтылған жағын, сонан соң жылтыр жағын қаратып қоямыз. Сонда манометрдегі сұйықтың бағаны екіншіге қарағанда бірінші жағдайда көбірек аралыққа жылжиды. Ендеше, қараға қарағанда ақ бет энергияны нашар жұтады. Бірдей температурада үстіңгі беті ақ денелер қараларға қарағанда энергияны да аз шығарады.
Мұны келесі тәжірибе арқылы дәлелдеуге болады.
Біреуі – ақ, екіншісі – қара бояумен боялған бірдей екі ыдысқа қайнаған су құйып, термометрлер салады. Біршама уақыттан кейін, қара ыдыстағы су –тезірек, ал ақ ыдыстағысы баяу суитынын термометрлер арқылы анықтауға болады.
Қара беттер – жақсы сәле шығарғыштар және жақсы жұтқыштар, сонан соң бұлдыр, ақ және жалтыр беттер келеді.
Энергияны жақсы жұтқыштар – сәулені жақсы шығарғыштар, ал сәулені нашар жұтқыштар – энергияны нашар бөлетіндер.
ІІ. Күн – физикалық тұрғыдан алғанда, өзін-өзі басқара алатын зор энергия көзі. Энергияның бөлінуі, оның радиусының 1/3 бөлігіне дейін созылатын орталық бөлігінде өтеді.
Күн жүйпесі шамамен 5 млрд жылдан бері бар; Күн диаметрі 1,392*106км-ге тең; Күннің центріндегі ең жоғарғы температура – 13*106 К; Жерден Күнге дейінгі қашықық – 149,6 млн км; Күн бетінің температурасы –6*103 К.
Радиустың үштен екі бөлігінде тек кана энергияны жүту және қайта шығару жолымен энергия тарататын қабаттар орналасқан. Бұл процесс сыртқы температураның азаюына жағдай жасайды.
Радиустың соңғы үштен бірін қайнаған сұйыққа ұқсас зат алып жатады. Онда энергияны сыртқа тезірек тасымалдауға мүмкіндік беретін конвекция (конвекциялық аумақ), яғни заттардың
араласуы жүреді.
Сәулелену байқалатын Күннің сыртқы қабаттарын атмосфера деп атайды. Атмосфераның касиеттері мен онда жүретін құбылыстар — көп жағдайда конвекциялық аймақпен анықталады: ондағы көтерілетін ыстық газдардың жекелеген массалары атмосфераның төменгі қабаттарын тербелуге мәжбүр етеді. Бұл
тербелістердің нәтижесінде жоғарыға қарай таралатын толқындар пайда болады. Бұл толқындар сыртқы қабаттардың газына өзінің энергиясын беріп, оны қыздырады. Осыған байланысты, Күн атмосферасының температурасы қандай да бір деңгейден бастап азаюын доғарады да, арта бастайды. Тіршілік пайда болғаннан бұрын Жер үстіндегі атмосферада түрлі құбылыстар өтіп, жай қарапайым заттар күрделене бастаған, яғни жөнделу құбылыстары басым болған.
Жердің даму тарихының алғашқы кезеңіндегі атмосфера сутегінен, оттегінен, көміртегінен және азоттан құралған. Соған байланысты онда су, көмірқышқыл газ, метан, сутегі, аммиак сияқты молекулалар болған. Күннің күлгін сәулелерінің, ғарыштық сәулелердің, радиоактивтік минералдың, атмосфераның қозғалысқа келу әсерінен электрлік құбылыстар жиі болып тұрған. Осылардың әсерінен С – Н, Н – О, H – N, Н – Н байланыстары үзілген және энергияға бай ортаарлық заттар түзілген. Заттар өзара әрекеттенуінен синил қышқылы, құмырысқа қышқылы, формальдегид, гликоль альдегиді,сірке қышқылы секілді молекулалары құрылған. Жоғары энергия квантының әсерінен органикалық қосылыстар молекуласы күрделі түрге айналған. Энергияның үлкен мөлшерінің одан әрі қарай әсер ете беруі анағұрлым күрделі молекулалардың пайда болуына әкеп жеткізген. Мысалы, амин қышқылдары: глицин, аланин, аспарагин қышқылы.Органикалық молекулалардың көбейіп, топтасуы түрлі құбылыстардың болуына себеп жасап, полисахаридтердің, ДНК, белоктардың, және тағы басқа заттардың пайда болуына жеткізді. Бұлар өмірдің негізгі сипаттамасы – энергия және информация қасиетін тасымалдайтын құрамдар.Органикалық молекулалардың абиогендік түзілуіне және өмірдің пайда болуында ядролық энергия маңызды роль атқарған. Зертханалық тәжірибелерде ерекше жағдай жасағанда (әр түрлі үлкен мөлшерде энергия, иондық сәулелену, электр зарядтары әсерінен) органикалық молекулалардың аса қарапайым заттардан пайда болатынын А.И. опарин және тағы басқа оқымыстылар көрсеткен. Мысалы, амин қышқылдары, нуклеотидтер, үш фосфорлы аденозин қышқылы /АТФ/ және тағы басқа тәжірибеде алынған.
81.Атомдық спектрдегі заңдылықтар. Квант теориясы тұрғысынан сутегі
атомын түсіндірейік. Сутегі атомында ядроны тек бір ғана электрон айналып
жүреді. Сутегі атомының ядросын (протон) қозғалмайды деп ұйғарып, электронның
қозғалу орбитасын дөңгелек деп алайық. Сонда электронды орбитада ұстап
тұратын центрге тартқыш күш (Fц.т.) электрон мен протонның арасындағы кулон
күшіне тең (Fк.) болады: Fц = Fк (1)
n-кванттық сан; n =1,2,3,..., (3) формуладағы n шамасынан басқаның бəрі
тұрақты шамалар. Олай болса, стационар орбиталар радиустарының
қатынастары: (:::... 1 2 3 r r r) натурал сандар қатары квадраттарының
қатынастарындай (1:4:9:…) болады, яғни:::...= 1 2 3 r r r 1:4:9:… Бірінші стационар
орбитаның (n=1) радиусы (1 r) мынаған тең: 1 r =0.53*10-10 м.
Екінші орбитаның радиусы: 2 r =4 1 r =2.12*10-10 м.
Үшінші орбитаның радиусы: 3 r =9 1 r =4.77*10-10 м. т.с.с.
Электронның орбитасының радиусын немесе электронның жылдамдығын
дəл өлшеуге келе бермейді. Сондықтан теорияның дұрыс екенін тексеру үшін
өлшеуге келетін физикалық шама қажет. Ондай шама атомның шығаратын жəне
жұтатын энергиясы болып саналады.
Сутегі атомының стационар күйіндегі энергиясы (Е) электронның ядроны
айнала қозғалғанда кинетикалық (Ek) энергиясымен электронмен ядро
арасындағы потенциялдық (En) энергияларының қосындысына тең болады.
Ал кинетикалық энергия:;
Бір-бірінен r қашықтықта орналасқан оң жəне теріс зарядталған екі дененің
(протон мен ядро) потенциялдық энергиясы:
(-) таңбасы екі дене біріне-бірі жақындаған сайын, олардың потенциялдық
энергияларының кеми беретінін көрсетеді. (4) жəне (5)-дан толық энергиямыз:
(7) формула сутегі атомының стационар күйінің энергиясы теріс екенін
көрсетеді. (7) пайдаланып кез келген стационар орбитадағы электронның
энергиясын табуға болады.
I-орбита үшін (n=1), сонда 13,65 1 E =− эВ. Бұл энергияны негізгі күйдің (n=1)
энергиясы деп атайды. Егер атом негізгі күйде тұрған болса, онда электронды
атомнан “жұлып” алып кету үшін 13,6 эВ энергия керек болады екен. Сонымен
негізгі күйде тұрған сутегі атомының байланыс энергиясы мен иондалу энергиясы
біріне-бірі тең жəне ол мынаған тең:
n - бас кванттық сан атом энергиясын анықтайды.
13,65 1 E =− эВ тең болатын күйді негізгі күй деп атайды. Егер n>1 болса,
онда оған сəйкес келетін күйді қозған күй деп атайды. Негізгі күй тұрақты
болады да, ал қалған күй тұрақсыз болады.
Атомның 1 E, 2 E, 3 E энергия мəндерінің жиынтығын энергетикалық
деңгейлер жүйесі ретінде қарастыруға болады.
n өскен сайын деңгейлердің орналасуы жиілей түседі. Егер электрон жоғарғы
орбитадан төменгі орбитаға көшсе, онда атом квант энергиясын шығарады, ал
электрон төменгі орбитадан жоғарғы орбитаға көшетін болса, онда атом квант
энергия жұтуы керек.
Мыс. Электрон бір орбитадан екінші орбитаға көшуі үшін оған энергия беру
керек. Сонда ғана атом қозған күйге келеді. Атом белгілі бір жиіліктегі толқынды
жұта алады немесе шығара алады дейміз. Міне осыдан сутегі атомының спектрі
сызықты болғандағы шығады__
82.Сутегі атомының спектріндегі заңдылықтар. Квант теориясы тұрғысынан сутегі атомын түсіндірейік. Сутегі атомында ядроны тек бір ғана электрон айналып жүреді. Сутегі атомының ядросын (протон) қозғалмайды деп ұйғарып, электронның қозғалу орбитасын дөңгелек деп алайық. Сонда электронды орбитада ұстап тұратын центрге тартқыш күш (Fц.т.) электрон мен протонның арасындағы кулон күшіне тең (Fк.) болады Fц=Fk (1)
Бордың бірінші постулаты бойынша атомда электрондардың белгілі бір стационар орбиталары бар. Бор стационар орбиталар үшін мына шарт орындалуы тиіс деп тұжырымдады:
merv=nħ мұндағы n =1,2,3,.... Бұл шарт бойынша стационар орбиталардағы электронның импульс моменті ħ Планк тұрақтысынан бүтін еселікке үлкен дискретті мәндерге ғана ие бола алады. Сонымен бірге Бор атом ядросының өрісінде қозғалып жүрген электронға Ньютонның екінші заңы мен Кулон заңын қолдануға болады деп есептеді. (Ал оның ұсынған өрнегі классикалық физикаға қарама-қайшы екенін ескерте кетейік.)Заряды Ze атом ядросының өрісінде бір электрон қозғалып жүрген жүйені қарастырайық. Егер Z = 1 болса, бұл сутегі атомы, ал егер Z > 1 болса, бұл сутегі тектес атом, яғни ион. Ядро тарапынан электронға kZe2/r2 Кулон күші әрекет етеді, бұл күш Ньютонның екінші заңы бойынша электронның массасы мен үдеуінің көбейтіндісіне тең. Электрон дөңгелек орбитамен қозғалады, сондықтан оның центрге тартқыш үдеуі v2/r. Олай болса,
mev2/r=kZe2/r2
өрнегінен ν жылдамдықты тауып, өрнегіне қойсақ:
n2ħ2/mer=kZe2,
бұдан электронның стационар орбитасының радиусы:
rn=(ħ2/kme)n2
Егер өрнегінде n = 1, Z = 1 болса, сутегі атомындағы электронның бірінші стационар орбитасының радиусын анықтаймыз. Оны r0 әрпімен белгілеп, Бор радиусы деп атайды:
r0=ħ2/kmee2=0,529*10-10м
Бұл мән молекулалы-кинетикалық теория бойынша есептелген сутегі атомы радиусының мәнімен сәйкес келеді. Стационар орбитадағы электронның толық энергиясы оның кинетикалық энергиясы және ядромен әрекеттесу кезіндегі потенциалдық энергиясының қосындысынан тұрады:
E=mev2/2+kZe2/r.
Соңғы теңдеуді өрнегін пайдалана отырып, мынадай түрге келтіруге болады: Еn=-kZe2/2r. Бұл өрнектегі радиустың орнына өрнегін қойсақ, атомның ішкі энергиясының мүмкін мәндерін алуға болады:
Еn=(k2mee4/2ħ2)(Z2/n2)
Мұндағы k=1/4  ε0 SI жүйесінде берілген. n = 1, 2, 3,... бүтін сандары негізгі кванттық сандар деп aталады.
ε0 SI жүйесінде берілген. n = 1, 2, 3,... бүтін сандары негізгі кванттық сандар деп aталады.
Сонымен, атомның энергиясы тек өрнегімен анықталатын дискретті мәндерді ғана қабылдай алады. Сутегі атомы үшін Z = 1, ал оның энергиясының мәндері былай анықталады:
En=-(k2mee4/2ħ2)(1/n2).
Сызықтың шығару және жұтылу спектрлері Бор теориясында атомдардың энергиясы өрнегімен анықталатын дискретті мәндерге ғана ие бола алатынымен түсіндіріледі. Бір химиялықэлементтің барлық атомдарының энергетикалық деңгейлері бірдей. Электрон бір деңгейден екінші деңгейге ауысқанда фотон сәуле шығарады. Басқа элемент атомдарының энергетикалық деңгейлерінің құрылымы басқа, сондықтан шығару және жұтылу спектрлері өзгеше болады.
Бордың екінші постулатынан сәуле шығару жиілігін анықтайық:
hν=En-Em, ν=En/2  ħ-Em/2
ħ-Em/2  ħ.
ħ.
Соңғы өрнекте ħ=n/2  екенін ескердік. Энергияның мәніне өрнегін қойсақ,
екенін ескердік. Энергияның мәніне өрнегін қойсақ,
ν=k2mee4/4  ħ3(1/m2-1/n2)
ħ3(1/m2-1/n2)
аламыз. Егер
R=k2mee4/4  ħ3
ħ3
деп белгілесек, өрнегі Бальмердің формуласымен сәйкес келеді. Өрнегіне кіретін шамалардың бәрі белгілі тұрақтылар, олардың мәндерін орнына қойып, R Ридберг тұрақтысын есептеп шығаруға болады. Осындай есептеулердің нәтижесі тәжірибеден алынған мәнмен бірдей болып шыққан. Жиіліктердің формуласымен есептелген мәндері де эксперименттіңнәтижесімен дәл келеді.
Бор теориясы атом құрылымының теориясын жасаудағы алғашқы қадам болып табылады. Ол классикалық физика заңдылықтарын микроәлем физикасының құбылыстарына қолдануға жарамайтының айқын көрсетіп берді. Бірақ алғашқы жетістіктерден соң Бор теориясы көптеген қиындықтарға кездесті. Мысалы, ол сутегінен кейінгі ең қарапайым гелий атомының теориясын жасауда толық сәтсіздікке ұшырады. Сәтсіздіктердің басты себебі теорияның ішкі логикалық қарама-қайшылығында еді, ол жартылай классикалық, жартылай кванттық көзқарастарға сүйенді. Қазіргі кезде Бор теориясы, негізінен, тарихи қызығушылық тудырады. Бірақ бұл теория қазір де бірқатар маңызды физикалық ұғымдарды (мысалы, энергетикалық деңгейлер ұғымын) енгізуге қолданылатын ыңғайлы механикалық модель болып табылатынын есте ұстаған жөн. Сонымен, Бор теориясы кванттық механиканы құрудағы өтпелі кезең болып табылады
Спектрлік термдер.
Сутегі тəріздес атомның қандай жағдайда сəуле шығаратындығын анықтау, яғни сұрьштау ережелерін тағайындау үшін мынадай матрицалық элементтерді есептеу қажет:
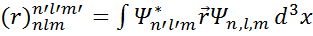 (1)
(1)
Мұнда
 (θ,φ)R nl (r) (2)
(θ,φ)R nl (r) (2)
Егер толқындық функцияны(1)-ші матрицалық элементтерге қойсақ
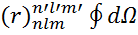 (
( )*
)*  R n l r2
R n l r2  (3)
(3)
θ жəне ϕ бұрыштары бойынша интегралдау орбиталық кванттық сан l мен магниттік кванттық сан m бойынша сұрыптау ережелерін береді:
∇l=l'-l=±1
∇m= m'-m=0±1
Сонда(1)-ші теңдеудің орнына мынадай матрицалық элемент аламыз:
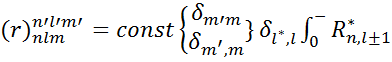 r3Rnldr (4)
r3Rnldr (4)
Сəуле шығару жиілігі
wnn'=  =(n'l’)- (nl) (5)
=(n'l’)- (nl) (5)
мұндағы (En/ћ) =(nl) спектрлік терм деп аталады.
Не нашли, что искали? Воспользуйтесь поиском: