
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Термодинамиканың екінші заңы. Термодинамиканың екінші бастамасының статистикалық сипаттамасы.
Екі әр түрлі газдар сыртқы әсерсіз молекулалардың жылулық қозғалысы себебінен бір-бірімен араласады. Өзара диффузия процесі кезінде пайда болған газдың қоспасы өздігінен қайтадан бөлінбейді. Газдардың диффузиялық араласуы қайтымсыз процесс, онда энтро-пияның өсуі байқалуы керек.
Көлемдері 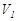 және
және 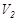 екі ыдыс (колбалар) капиллярмен жалғас-қан әр түрлі бір моль идеал газбен толтырылған. Осы екі көлемді жалғастыратын капиллярды ашсақ, газдар араласып, қоспасы
екі ыдыс (колбалар) капиллярмен жалғас-қан әр түрлі бір моль идеал газбен толтырылған. Осы екі көлемді жалғастыратын капиллярды ашсақ, газдар араласып, қоспасы 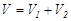 көлемге жайылады. Бұл процесті әр газдың тұрақты температурада ұлғаюы деп қарастыруға болады: бірінші
көлемге жайылады. Бұл процесті әр газдың тұрақты температурада ұлғаюы деп қарастыруға болады: бірінші 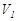 көлемнен
көлемнен 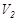 -ге дейін, ал екіншіні
-ге дейін, ал екіншіні 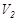 -ден
-ден 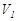 -ге дейін. Осы кезде бірінші газдың энтропиясы
-ге дейін. Осы кезде бірінші газдың энтропиясы 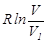 шамаға дейін, ал екіншіні
шамаға дейін, ал екіншіні 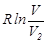 өзгереді. Онда энтропияның жалпы өзгерісі
өзгереді. Онда энтропияның жалпы өзгерісі 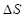 тең болады:
тең болады:
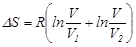 , (7.59)
, (7.59)
мұндағы 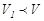 және
және 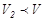 , демек
, демек 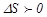 , жүйенің энтропиясы өсті.
, жүйенің энтропиясы өсті.
7.10. Термодинамиканың екінші бастамасының статистикалық сипаты. Энтропияның физикалық мағынасы
Термодинамиканың екінші бастамасы қайтымсыз процестерде энтропия өсіп, жүйенің тепе-теңдік күйіне сәйкес максимал мәніне жететінін тағайындайды. Энтропияның өсуі жылулық процестің өтуі-мен байланысты. Мұнда шашыраған энергия ешқашан қайтарыл-майды, бұл энергияның шашырауының қайтымсыздығы макроскоп-тық деңгейдегі тәжірибенің нәтижесі.
 Дененің жылулық энергиясы оның құрамындағы молекулалардың ретсіз, хаосты қозғалысының энергиясымен анықталады. Олай болса, термодинамиканың екінші заңына бағынатын макроскоптық деңгей-дегі энергияның өзгерісінің қайтымсыздығы, микроскоптық деңгейде толығымен молекулалардың қайтымды әрекеттесуімен сипатталады. Сонымен, жылулық энергияның механикалыққа айналуы хаосты жылу-лық қозғалысты ретті қозғалысқа айналдырады. Керісінше, механикалық энергияны жылулыққа айналдыру деген реттік энергияны ретсіздік энергияға айналдыру деп айтуға болады.
Дененің жылулық энергиясы оның құрамындағы молекулалардың ретсіз, хаосты қозғалысының энергиясымен анықталады. Олай болса, термодинамиканың екінші заңына бағынатын макроскоптық деңгей-дегі энергияның өзгерісінің қайтымсыздығы, микроскоптық деңгейде толығымен молекулалардың қайтымды әрекеттесуімен сипатталады. Сонымен, жылулық энергияның механикалыққа айналуы хаосты жылу-лық қозғалысты ретті қозғалысқа айналдырады. Керісінше, механикалық энергияны жылулыққа айналдыру деген реттік энергияны ретсіздік энергияға айналдыру деп айтуға болады.
Осы мәселенің шешімін тапқан атақты физик Людвиг Больцман. Ол энтропияның физикалық мағынасын ашып және энтропия мен ықтимал-дықтың байланысын анықтады. Больцманның тағайындауы бойынша, энтропияның қарапайым статистикалық түсініктемесі болады. Больцман энтропияны молекулалық деңгейде зерттеу үшін қарапайым ойша келесі эксперимент ұсынды.
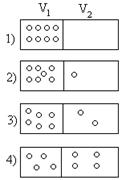
Мысалы, бізде екі тең бөлікке қалқамен бөлінген ыдыс және сегіз әр түрлі молекула бар делік. Молекулалар бильярд шарлары тәріздес, бірден сегізге дейін нөмірлеп, белгіленген. Ыдыстың оң және сол жақ бөліктерінде молекулалардың таралу тәсілдерінің санын есептейік (7.7-сурет).
Алдымен барлық сегіз бөлшек сол жақтағы ыдыстың бөлігінде делік. Бұл күйді тек бір тәсілмен жүзеге асыруға болады. Егер біз жеті бөлшекті солға, ал біреуін оңға орналастырсақ, онда сегіз тәсілмен бұл күйді жүзеге асыра аламыз. Молекулалар әр түрлі, сондықтан осы сегіз тәсілдер әр түрлі комбинациялар Больцман бойынша құрайды. Бұл тәсілдер санын Больцман комплексия деп атаған. Ықтималдықтар теориясы бойынша (3 бөлім) бұл тәсілдер саны былай анықталады:
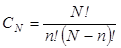 , (7.60)
, (7.60)
мұндағы N – молекулалар саны, N=8; n – бір бөлігіндегі молекула саны.
Мысалы, 1) барлық N=8 молекулалар сол жақтағы бөлікте (7.7-сурет), ал оң жақта n=0, онда (7.60) бойынша бұл күйі тек бір тәсілмен жүзеге асырылады;
2) сол жақта –7, ал оң жақта 1 молекула орналасты делік, онда 8 тәсілдер жүзеге асырылады;
Осындай есептеулер жүргізгенде, оң мен сол жақтағы молекулалар санының айырмасы азайған сайын, тәсілдер комбинациясы өсіп, екі жақтағы молекулалар саны теңелгенде максимумға жетеді. Біздің мысалда оң және сол жақта молекулалар саны теңеліп, төрттен болғанда, тәсілдер комплексия саны 70-ке тең болады.
Больцман бойынша неғұрлым комплексия саны кіші, солғұрлым реттілік (тәртіптік) жоғары болады. Біздің мысалда сегіз бөлшек бір жаққа орналасқанда жүйенің күйі ең жоғарғы реттілікке сәйкес, ал тең төрттен орналасқан бөлшектер күйі ең максимал ретсіздікті анық-тайды.
Айта кетейік, Больцманның реттілік концепциясы термодинами-калық, себебі молекулалар үздіксіз қозғалыста болады, ал біздің тәжі-рибе елес, ойша болжам. Термодинамикалық көзқарас механикадағы реттілік туралы қатаң көзқарастан ерекше. Тағы өзіміздің өмірден бір мысал келтірейік. Қапшықты екі түсті (ақ және қара) құммен толтырайық. Төменгі жартысы – қара құм, жоғарғы жартысы – ақ құм болсын. Бұл біздің жүйенің алғашқы күйі өте жоғары реттілікке ие, себебі бір ғана комплексия мүмкін болады. Енді қапшықты сілкіп жіберсек, ақ және қара құм араласа бастайды. Осы араласу процесі құм (жүйе) бірқалыпты сұр түсті қоспа болғанда тоқталады, сонымен тепе-теңдік күй орын алады, демек максимал ретсіздік орналасады.
Осындай ойша талдаулар нәтижесінде Больцман өз еркіне жіберіл-ген оқшауланған жүйенің ықтималдығы кем күйден ықтималдығы артық күйге көшеді деп болжаған. Олай болса, жүйенің реттіліктен реттсіздікке көшуі, Больцман бойынша, ықтималдығы кем күйден ықтималдығы артық күйге көшуі деген. Неғұрлым молекулар саны қисапсыз көп, солғұрлым жүйенің реттіліктен реттсіздікке көшу ықтималдығы жоғары және ең ықтималды күйге түскен жүйе, сол күйде шектеусіз ұзақ уақыт қала береді, демек бұл ықтималдық практикада нақты қасиеттің ақиқаттығын белгілейтін болады.
Сөйтіп, оқшауланған жүйенің энтропиясы мен ықтималдығының қасиеті бірдей: олар не арта (өсе) алады, не өзгеріссіз қала береді өте-тін процестерге байланысты.
Келтірілген нәтижелер оқшауланған жүйенің энтропиясы мен ықтималдығының арасында нақты қатынасты тағайындауға мүмкін-дік берді. Больцман бойынша бұл қатыстың түрі мынадай болады:
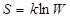 , (7.61)
, (7.61)
мұндағы W – термодинамикалық ықтималдық макроскоптық күйдің статистикалық салмағымен анықталады, 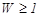 ; k – Больцман тұрақ-тысы.
; k – Больцман тұрақ-тысы.
Сонымен энтропияның физикалық мағынасы термодинамикалық ықтималдықтың логарифмінің байланысы арқылы анықталады. Себебі термодинамикалық ықтималдықпен энтропия тікелей байланысты: екеуіде тепе-теңдік күйде максималмәндеріне жетеді және кез келген нақты жүйенің тепе-теңдікке өтуі энтропияның да және термодинами-калық ықтималдықтың өсуіне әкеледі, демек процестің өту бағытына сәйкес.
Термодинамикалық ықтималдық W математикалықпен P байла-нысты, бірақ P әрқашанда бірден кіші, ал W өте үлкен сандармен анықтлады. Біздің ойша өткізген тәжірибеміздегі (7.7-сурет) N бөл-шектен құралған газдың ыдыстың v бөлігінде орналасу ықтималдығы (7.1) бойынша мынаған тең:
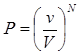 .
.
Термодинамикалық ықтималдық W осыған кері шамамен анықта-лады:
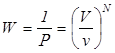 . (7.62)
. (7.62)
Сонымен, газдың бүкіл V көлемге таралу процесінің қайтымсыз-дығы, оған кері процестің ықтималдығының кіші болуынан екен.
Осыған орай, термодинамиканың екінші заңы барлық табиғаттағы өтетін процестерде жүйе термодинамикалық ықтималдығы жоғары күйлерге ауысып отыратынын тағайындайды.
Қорытындылай келе, энтропияның қасиеттерін тағы да ескерте кетейік:
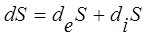 , (7.63)
, (7.63)
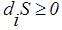 ,
,
мұндағы теңдік белгісі тепе-теңдік күйге қатысты; i–ішкі, е – сыртқы параметрлер белгісі;
diS = 0 (қайтымдыпроцестер),
diS> 0 (қайтымсызпроцестер).
Егер (7.63)-тегі өрнекте
deS = 0,
онда
dS ³ 0
термодинамиканың екінші заңының бір түрі.
Қоршаған ортамен тек энергиямен алмасатын жабық жүйелер үшін Карно-Клаузиус теоремасы бойынша:
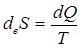 ,
,
мұндағы 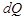 – жүйеге сырттан берілетін жылу, Т – температура.
– жүйеге сырттан берілетін жылу, Т – температура.
Сонымен, оқшауланған жүйелер үшін
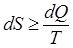 (7.64)
(7.64)
термодинамиканың екінші заңының белгілі түрі.
Энтропияның максимал мәні жүйенің тепе-теңдік күйіне сәйкес келеді, демек 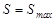 энтропия жүйенің ретсіздігінің өлшеуіші болады.
энтропия жүйенің ретсіздігінің өлшеуіші болады.
Қайтымсыз процесте энтропияның өсуі жүйенің энергиясының механикалық жұмысқа айналуының қолайсыздау жақтарын белгілейді. Тепе-теңдік күйдегі жүйенің энергиясы, энтропия максимал мәніне жеткенде, тіпті жұмысқа айналдырылмайды.
Не нашли, что искали? Воспользуйтесь поиском: