
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Третий закон термодинамики
Первый закон термодинамики, являясь математическим выражением количественной стороны закона сохранения и превращения энергии в применении к термодинамическим системам, устанавливает, что количество теплоты, подведенное к системе, затрачивается на изменение внутренней энергии и на совершение различных работ:
δQ = dU + δL + δA
Протекание химических реакций связано с изменением состояния атомов в молекулах реагирующих веществ. При этом происходит изменение внутренней энергии, которое может проявляться в виде теплоты и различных работ.
С учетом того что в ходе химической реакции основным источником энергии является внутренняя энергия, изменение которой идет на выделяющуюся теплоту (теплоту реакции) и различные работы, основное уравнение первого закона применительно к химическим реакциям записывают в виде
ΔU = Q – L – A,
где Q — теплота реакции; L = V1∫V2 р dV — работа изменения объема (против внешних сил); А — сумма работ против электрических, световых, магнитных, звуковых и других сил, проявляющихся в ходе химической реакции и сопутствующих воздействий.
Уравнение первого закона термодинамики, выраженное через энтальпию, можно представить в виде
ΔI = Q + p1∫p2Vdp – A
Рассмотрим процессы, когда фиксированными являются два параметра: V, Т = const или р, Т = const.
Для процесса при V, Т = const уравнение запишется в виде
ΔUV,T = QV,T – AV,T
или
AV,T = QV,T – ΔUV,T (*)
Для процесса при р, Т = const уравнение будет иметь вид
ΔIp,T = Qp,T – Ap,T
или
Ap,T = Qp,T – ΔIp,T (**)
В приведенных уравнениях изменения внутренней энергии и энтальпии происходят за счет отвода теплоты реакции и совершения работы.
Выражая теплоту через изменение энтропии в виде Q = T(S2 – S1) и учитывая, что
F = U – TS, – изохорно-изотермический потенциал или свободная энергия Гельмгольца (мера работоспособности системы)
G = I – TS, – изобарно-изотермический потенциал или свободная энергия Гиббса (определяет наличие обратимых и/или необратимых процессов в системе)
уравнения (*) и (**) перепишутся в виде
AV,T = (F1 – F2)V,T
Ap,T = (G1 – G2)p,T
Дифференцируя F = U – TS, получаем
dF = dU – TdS – SdT.
Учитывая, что в обратимых процессах
TdS = dU + pdV
или
dU – TdS = – pdV,
получаем
dF = –SdT – pdV.
Продифференцируем это уравнение по Т при V = const.

превращается в частную производную и принимает вид
 , откуда
, откуда 
Следовательно:

При переходе термодинамической системы из одного состояния в другое в обратимом химическом процессе при постоянных V, Т совершается максимальная работа

При записи теплового эффекта химической реакции в виде QV = (U2 – U1)V,T получаем
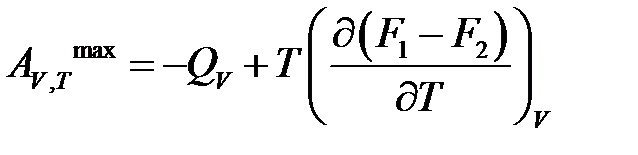
Аналогично, если рассмотреть химическую реакцию в условиях термодинамической обратимости, протекающую в изобарно-изотермической термодинамической системе при постоянных р, Т, получим


Уравнения для  и
и  называются уравнениями максимальной работы Гиббса-Гельмгольца, в которых очень часто индекс «mах» не пишут, т.к. знак равенства уже означает термодинамическую обратимость и, следовательно, – максимальную работу реакции.
называются уравнениями максимальной работы Гиббса-Гельмгольца, в которых очень часто индекс «mах» не пишут, т.к. знак равенства уже означает термодинамическую обратимость и, следовательно, – максимальную работу реакции.
В экспериментах было обнаружено, что чем ниже температура, тем меньше разность ( )
)
Однако, равенство  соблюдается не только при температуре, равной нулю, но и вблизи нуля температур по шкале Кельвина, т.е.
соблюдается не только при температуре, равной нулю, но и вблизи нуля температур по шкале Кельвина, т.е.

Этот постулат, сформулированный для конденсированных систем, получил название тепловой теоремы Нернста.
Ранее было установлено
Ap,T = (G1–G2)p,T
Записав дополнительно


следует, что изменение энтропии вблизи нуля температурной шкалы Кельвина также равно нулю, т.е.  (постулат Планка или третий закон термодинамики), т.е. энтропия перестаёт быть функцией состояния.
(постулат Планка или третий закон термодинамики), т.е. энтропия перестаёт быть функцией состояния.
Фактически Планк предположил, что при температуре Т = 0 К не только алгебраическая сумма энтропии твердых тел, но и энтропия каждого тела в отдельности также равняется нулю  .
.
Из положения теоремы Нернста о том, что энтропия системы вблизи Т = 0 К не изменяется, следует, что в этой области не происходит теплообмена системы с окружающей средой (изотермический процесс является также и адиабатным). Таким образом, система, еще не достигнув температуры Т = 0 К, приходит в такое состояние, что достижение абсолютного нуля становится практически невозможным как путем адиабатного расширения, так и путем изотермического процесса.

Рассмотрим цикл Карно с температурой теплоотдатчика Т1 = Т и температурой теплоприемника Т2 = 0.
По второму закону термодинамики, для кругового процесса § dQ/T = 0 или Δs12 + Δs23 + Δs34 + Δs41 = 0, где Δs12 = Q/T, Δs23 = 0 (адиабатный процесс); Δs34 = 0, Δs41 = 0 (адиабатный процесс).
Следовательно, в результате проведения такого цикла, который дает возможность получать непрерывную работу за счет охлаждения одного теплоотдатчика, можно создать вечный двигатель второго рода, что, согласно второму закону термодинамики, невозможно.
Или: невозможно создать машину, которая в качестве низшего источника теплоты имела бы тело с Т = 0 К, или вечный двигатель третьего рода неосуществим.
Известно еще несколько формулировок третьего закона термодинамики. Одна из них звучит следующим образом: в любом изотермическом процессе, который происходит при температуре, близкой к абсолютному нулю, изменение энтропии системы равно нулю.
Поскольку  , то
, то 
т.е. теплоемкость не изменяется вблизи абсолютного нуля и стремится к нулю.
Нернст сделал вывод, являющийся другой формулировкой третьего закона термодинамики: никаким конечным процессом нельзя охладить тело до абсолютного нуля температур, или более коротко — абсолютный нуль температур недостижим.
| <== предыдущая лекция | | | следующая лекция ==> |
| Переменная себестоимость единицы продукции | | | ысқа химиотерапия курсының (ҚХК) негізгі ерекшеліктері. |
Не нашли, что искали? Воспользуйтесь поиском: