
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Тепловой эффект (энтальпия) химической реакции».
Химия
Тепловой эффект (энтальпия) химической реакции.
Методические указания
к выполнению лабораторной работы
Санкт-Петербург
2015 год
Составители: Николаев Ю.С.,Крылова Т.Е
Рецензент канд. техн. наук, доцент Волохов М.А.
Содержатся методические указания к выполнению лабораторной работы.Даны примеры решения задач и контрольные задания.Предназначены для всех специальностей, направлений.Подготовлены к публикации кафедрой технической физики, электромеханики и робототехники.
Методические указания предназначены для всех технических специальностей, направлений.
Лабораторная работа:
Тепловой эффект (энтальпия) химической реакции».
Цель работы: ознакомление с основными принципами химической термодинамики, определение энтальпии химической реакции нейтрализации.
1.Теоретические сведения.
Основы термодинамики как науки были заложены в первой четверти XIX века. С одной стороны, они базировались на научных исследованиях XVIIIвека (закон сохранения энергии), а с другой- на практической необходимости создания теории паровых машин (а в дальнейшем и других тепловых машин). Химическая термодинамика как раздел общей термодинамики изучает закономерности перехода одних форм энергии в другие (например, энергии химических реакций, электрохимических процессов в тепло и др.). Термин «энергия» в строгом смысле может быть определен через его физический смысл:  , где F- сила (Н), ℓ- расстояние (м). Однако такая упрощенная физическая трактовка термина «энергия» не отражает всего многообразия, которое вкладывается в него в термодинамике.
, где F- сила (Н), ℓ- расстояние (м). Однако такая упрощенная физическая трактовка термина «энергия» не отражает всего многообразия, которое вкладывается в него в термодинамике.
Любой процесс протекает самопроизвольно, если энергия системы уменьшается. Такой процесс энергетически выгоден и в термодинамическом смысле вероятен.
Классическая термодинамика основана на трех законах (началах), плюс нулевое начало термодинамики, постулирующее существование термодинамического равновесия. Первое начало термодинамики может быть сформулировано следующим образом: количество теплоты, полученное системой, идет на изменение ее внутренней энергии и совершение работы против внешних сил:

Такая формулировка справедлива для закрытых систем, в которых не происходит обмена веществом с окружающей средой, а так же если над системой не совершается работа внешними силами и полями (движущиеся системы), например, при переходе к более строгой математической формулировке это уравнение можно записать как

Для равновесных процессов 
Внутренняя энергия- функция состояния системы, определяемая параметрами давления (p), объема(V), температуры(Т) и т.д., ∆Uопределяется разностью U 2 –U 1и не зависит от пути процесса, в то время как δQиδА зависят от пути процесса, в результатекоторого состояние системы изменилось. Уравнение (2) может быть переписано как:
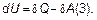
Такая математическая запись показывает, что для закрытых систем существуют две формы обмена энергией с окружающей средой: теплота и работа. При одинаковости единиц измерения эти две формы отличаются друг от друга прежде всего на «микроскопическом» уровне. Передача тепла, чаще всего, осуществляется путем передачи кинетической энергии частицы (хаотичное движение). Работа может совершаться лишь при направленном (организованном) движении частиц. Так паровые машины сконструированы таким образом, что молекулы пара могут увеличивать объем, в котором находятся, лишь в одном направлении. В этом случае полезная работа:

Электрический ток может совершить работу по перемещению электрического заряда в электростатическом поле с разностью потенциалов  где Е-разность потенциалов (В), q - заряд (Кл).В каждом конкретном случае необходимо учитывать тот вид работы, которая совершается, и тип процесса.
где Е-разность потенциалов (В), q - заряд (Кл).В каждом конкретном случае необходимо учитывать тот вид работы, которая совершается, и тип процесса.
В реальных неравновесных процессах знак равенства должен быть заменен на<или>.
Если реакция протекает при постоянном объеме (изохорный процесс), то работа расширения системы ( ) равна нулю. Если при этом не совершаются другие виды работы, то
) равна нулю. Если при этом не совершаются другие виды работы, то  где
где  количество поглощенной системой теплоты при постоянном объеме.
количество поглощенной системой теплоты при постоянном объеме.
Реальные химические процессы чаще протекают при постоянном давлении р (∆р=0 – изобарный процесс). В данном случае уравнение (1) может быть записано как:

Раскрывая скобки, можно записать уравнение так:
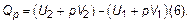
Выражение  является функцией состояния системы в изобарных процессах (не зависит от пути перехода). Ее называют энтальпией или энергосодержанием и обозначают Н.
является функцией состояния системы в изобарных процессах (не зависит от пути перехода). Ее называют энтальпией или энергосодержанием и обозначают Н.
Таким образом, из уравнения (6) следует, что сообщенное системе тепло при постоянном давлении идет на приращение энтальпии: 
В равновесных процессах  также приобретает свойства функции состояния.В термодинамике была принята система знаков, в которой тепловому эффекту экзотермических реакций приписывают знак «-» (система отдает тепло), а тепловому эффекту эндотермических реакций приписывают знак «+» (система получает тепло).
также приобретает свойства функции состояния.В термодинамике была принята система знаков, в которой тепловому эффекту экзотермических реакций приписывают знак «-» (система отдает тепло), а тепловому эффекту эндотермических реакций приписывают знак «+» (система получает тепло).
Для многих практических целей важно знать тепловой эффект при постоянном давлении (чаще всего при атмосферном). В дальнейшем будем оперировать только тепловым эффектом при постоянном давлении (изменением энтальпии), и если считать, что в системе не происходит иных видов работы, кроме работы по изменению объема, то:
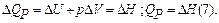
Тепловой эффект может быть рассчитан по закону Гесса (1840 г.), который был установлен эмпирическим путем, а позднее обоснован теоретически: тепловой эффект химической реакции, проводимой в изобарно-изотермических или изохорно-изотермических условиях, зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от пути ее протекания. Иными словами, количество теплоты, выделяющееся при каком-либо процессе, всегда одно и то же, независимо от того, протекает ли данное химическое превращение в одну или в несколько стадий (при условии, что температура, давление и агрегатные состояния веществ одинаковы).Так, для 298,15К теплоту образования оксида углерода (II) ( ) из графита можно рассчитать, зная, что теплоты сгорания
) из графита можно рассчитать, зная, что теплоты сгорания  при этой температуре равны соответственно -282,99 и -393,32 кДж/моль(см. рис. 1) Рассматривая два пути образования CO2из графита при непосредственном сжигании его до CO2и при промежуточном образовании СО и зная, что по закону Гесса общий тепловой эффект обоих путей перехода должен быть одинаковым, находим: -393,32-(-282,99)= -110,33 кДж/моль.
при этой температуре равны соответственно -282,99 и -393,32 кДж/моль(см. рис. 1) Рассматривая два пути образования CO2из графита при непосредственном сжигании его до CO2и при промежуточном образовании СО и зная, что по закону Гесса общий тепловой эффект обоих путей перехода должен быть одинаковым, находим: -393,32-(-282,99)= -110,33 кДж/моль.

Рис. 3
При этом следует учитывать стехиометрические коэффициенты реакции:

где nк и nН – число молей каждого из конечных и начальных продуктов; 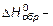 общий тепловой эффект (энтальпия).
общий тепловой эффект (энтальпия).
Тепловой эффект, соответствующий образованию 1 моля соединения из элементарных веществ, устойчивых в стандартных условиях, называется стандартной теплотой (энтальпией) образования данного соединения. Теплоту образования элементарных веществ (H2, O2, N2, C(графит), Cl2и др.) в стандартных условиях (p=1013 гПа, T =298К) условно принимают равными нулю. Стандартные теплоты (энтальпии) образования приводятся в справочниках.
Согласно закону сохранения массы и энергии Ломоносова, при образовании химического соединения поглощается или выделяется такое количество теплоты, какое выделяется или поглощается при его разложении на первоначальные составные части. Законами термохимии пользуются для вычисления тепловых эффектов реакций или теплот образования соединений, которые не могут быть определены опытным путем. В термодинамических уравнениях указывается агрегатное состояние и модификация вещества, если одно и тоже вещество может существовать в нескольких различных кристаллических модификациях.
Пример 1. Теплота сгорания этана  . Вычислить теплоту образования этана, если известно, что теплоты (энтальпии) образования воды и CO2 соответственно равны
. Вычислить теплоту образования этана, если известно, что теплоты (энтальпии) образования воды и CO2 соответственно равны  и
и 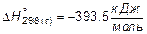 .
.
Решение. Реакция горения этана выражается уравнением:

Воспользовавшись выражением:

и подставив в него теплоты (энтальпии) образованияH2O, CO2иO2, находим:
 откуда
откуда 
На основании изучения тепловых эффектов химических реакций был сформулирован критерий, определяющий самопроизвольность их протекания. Самопроизвольно протекают те процессы (с образованием тех продуктов), которые сопровождаются выделением наибольшего количества энергии, т.е. все самопроизвольные процессы являются экзотермическими (принцип Бертло-Томсена).
Однако этот принцип соблюдается часто, но далеко не всегда: известно много самопроизвольно протекающих эндотермических реакций. Из чего следует, что на направление процесса влияет не только энтальпия, но и некая другая характеристика системы, которая была введена в термодинамику Рудольфом Клаузиусом в 1865 году и получила название «энтропия»:
 , для равновесного квазистатического процесса:
, для равновесного квазистатического процесса:

Уравнение (9) есть математическое выражение второго начала термодинамики. Известны несколько формулировок второго начала термодинамики. Р.Клаузиус предложил в основу постулат: «В природе неосуществим самопроизвольный процесс перехода теплоты от менее нагретого тела к более нагретому.» По У.Кельвину: «Процесс, при котором работа переходит в теплоту без каких-либо других изменений в системе, является необратимым, т.е. невозможно обратить в работу всю теплоту, взятую от источника с однородной температурой, не проводя других изменений в системе.» Энтропия, как и внутренняя энергия, энтальпия, является функцией состояния системы. Условно говоря, энтропия является мерой «свободы», «хаоса» системы. Людвиг Больцман установил связь энтропии с вероятностью данного состояния. Макс Планк представил эту связь в виде формулы:
 (10)
(10)
где 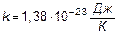 (постоянная Больцмана),
(постоянная Больцмана),  статистический вес состояния.
статистический вес состояния.  это число микросостояний (способов, вариантов), которые возможны в данном макросостоянии (например, при заданных давлении и объеме).
это число микросостояний (способов, вариантов), которые возможны в данном макросостоянии (например, при заданных давлении и объеме).
Чем больше число возможных микросостояний, тем больше неупорядоченность его общего состояния:

Энтропия возрастает при переходе вещества из кристаллического состояния в жидкое и из жидкого в газообразное, при расширении газов, при химических взаимодействиях, приводящих к увеличению числа частиц. Напротив, все процессы, в результате которых упорядоченность системы возрастает (конденсация, полимеризация, сжатие, уменьшение числа частиц) сопровождается уменьшением энтропии. Энтропия выражается в единицах энергии, отнесенных к произведению температуры и количества вещества  .
.
Со вторым началом связано третье начало термодинамики (теорема Нернста): энтропия равновесной системы при абсолютном значении нуля температуры равна нулю(S=0 при T=0). Исходя из этого начала, становится возможным рассчитать ее абсолютное значение (S) в отличие от dH, dU и других функций. Поскольку значение энтропии сильно зависит от температуры (увеличение температуры приводит к увеличению энтропии), абсолютное значение энтропии обычно приводится к “стандартной”температуре 298К.
Изменение энтропии системы 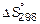 в результате химической реакции равно сумме энтропий продуктов реакции за вычетом суммы энтропий исходных веществ с учетом числа молей, участвующих в реакции:
в результате химической реакции равно сумме энтропий продуктов реакции за вычетом суммы энтропий исходных веществ с учетом числа молей, участвующих в реакции:

В отличие от энтальпии образования, энтропия простого вещества, даже в кристаллическом состоянии, не равна нулю. В изолированной системе самопроизвольные процессы протекают в сторону увеличения: энтропии  Если
Если  , то самопроизвольное протекание невозможно.
, то самопроизвольное протекание невозможно.
Пример 2. Пользуясь табличными данными, вычислить изменение энтропии 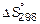 в реакции H2S(г) + Cl2(г) = 2HCl(г) + S(т).
в реакции H2S(г) + Cl2(г) = 2HCl(г) + S(т).
Решение. Для наглядности подставим под формулой вещества значение 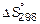 :
:
| Вещество | H2S(г) | Cl2(г) | HCl(г) | S(T) |
∆So298 
| 205,6 | 186,7 | 31,88 |
Из суммы энтропий продуктов реакции вычесть сумму энтропий исходных веществ:

Таким образом, в физико-химических системах одновременно существуют две конкурирующие тенденции: принцип стремления к минимуму энергии (принцип Бертло) и принцип максимума энтропии (преимущественно протекают процессы, в которых dS>0).Только одновременный учет этих двух факторов позволяет делать вывод о принципиальной возможности самопроизвольного протекания процессов в данных условиях.
В изобарно-изотермических условиях (p =const, T =const) таким критерием является энергия Гиббса (изобарно-изотермический потенциал, свободная энтальпия). В общем случае энергия Гиббса (dG) равна той части общей энергии системы, которая может быть использована для совершения полезной работы. Как энтропия и энтальпия значения dG приводятся при T=298K.
Энергия Гиббса связана с энтальпией и энтропией соотношением:
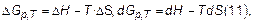 где T -значение температуры.
где T -значение температуры.
Значение  зависят не только от природы реагирующих веществ, но и от агрегатного состояния и условий. Для получения сравнимых данных, характеризующих различные реакции, сопоставляют стандартные изменения энергии Гиббса:
зависят не только от природы реагирующих веществ, но и от агрегатного состояния и условий. Для получения сравнимых данных, характеризующих различные реакции, сопоставляют стандартные изменения энергии Гиббса:
 (12)
(12)
Энергию Гиббса образования относят к одному молю вещества, выражают в 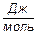 , при этом
, при этом  образования простого и наиболее устойчивого в данных условиях вещества принимают равной нулю.
образования простого и наиболее устойчивого в данных условиях вещества принимают равной нулю.
Изменение энергии Гиббса может быть записано следующим образом:

Первый член этого выражения представляет собой энтальпийный фактор, а второй-энтропийный. Первый отражает тенденцию системы к образованию связей в результате взаимного притяжения частиц, молекул и атомов, что приводит к их усложнению, а второй- тенденцию к усилению процесса диссоциации сложных частиц на более простые и их менее упорядоченному состоянию. Оба фактора действуют в противоположных направлениях, а общее направление реакции определяется суммой влияния обоих факторов.
При постоянных значениях p и Т возможно самопроизвольное протекание лишь тех реакций, изобарные потенциалы которых отрицательны;  , и чем меньше алгебраическая величина
, и чем меньше алгебраическая величина  реакции, тем больше ее движущая сила. В ходе реакции
реакции, тем больше ее движущая сила. В ходе реакции  увеличивается и при
увеличивается и при  в системе устанавливается равновесие. Если
в системе устанавливается равновесие. Если  , то реакция не может идти без затрат энергии, и такое неравенство свидетельствует о принципиальной невозможности протекания реакции при данных условиях (p и Т), а при неравенстве
, то реакция не может идти без затрат энергии, и такое неравенство свидетельствует о принципиальной невозможности протекания реакции при данных условиях (p и Т), а при неравенстве  , реакция неосуществима в любых условиях. Таким образом,
, реакция неосуществима в любых условиях. Таким образом,  является истинным критерием возможности протекания процесса в изобарно-изотермических условиях. Если реакция протекает при низких температурах и без участия газообразных веществ, то
является истинным критерием возможности протекания процесса в изобарно-изотермических условиях. Если реакция протекает при низких температурах и без участия газообразных веществ, то 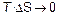 и
и  , т.е. критерием реакции может служить изменение энтальпии (действует принцип Бертло). В остальных случаях необходимо рассчитывать изменение энергии Гиббса.
, т.е. критерием реакции может служить изменение энтальпии (действует принцип Бертло). В остальных случаях необходимо рассчитывать изменение энергии Гиббса.
Пример 3. Вычислить стандартное изменение энергии Гиббса химического процессаNH3 + HCl = NH4Cl, если значение  и
и  реагирующих веществ:
реагирующих веществ:
| Вещество | NH3(г) | HCl(г) | NH4Cl(тв) |

| -46,19 | -92,30 | -315,39 |

| 192,50 | 186,70 | 94,56 |
Решение.
Определяем  реакции:
реакции: 
Определяем изменение энтропии реакции:

Находим изменение энергии Гиббса: 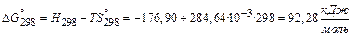
Так как  , данная реакция термодинамически возможна (протекает произвольно) и является экзотермической (
, данная реакция термодинамически возможна (протекает произвольно) и является экзотермической ( ).
).
Выполнение работы.
Задание. Определить тепловой эффект (энтальпию) реакции нейтрализацииHCl + NaOH = NaCl + H2O,сравнить измеренное значение  с теоретическим и вычислить относительную ошибку измерения.
с теоретическим и вычислить относительную ошибку измерения.
Лабораторное оборудование: Калориметр (рис. 2) включает в себя внутренний стакан (1), в котором проводится реакция, внешний стакан (2), теплоизоляционную прокладку (3), крышку (4), в которой имеются отверстия для термометра (5) и воронки (6). Для измерения массы реагирующих веществ используют лабораторные весы, для измерения объемов- мерные цилиндры. Для перемешивания растворов используют перемешивающее устройство(8) и магнитную мешалку(7).
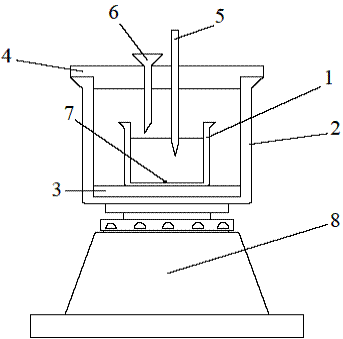
Рис. 2
Материалы и реактивы: растворыHClиNaOH.
Ход работы.
Взвесить внутренний стакан калориметра (m1), опустить в него мешалку и взвесить внутренний стакан с мешалкой(m2). Налить в стакан 45 мл щелочи соответствующей концентрации (1н или 2н). Взвесить стакан с объемом щелочи(m3). Собрать калориметрическую установку согласно рис.1. Включить магнитную мешалку. Провести предварительный период реакции, регистрируя изменение температуры через 1 мин в течение 5 минут. Ввести через воронку 40 мл раствора кислоты той же концентрации, что и щелочь. Регистрировать температуру в течение главного периода реакции. Продолжить регистрацию еще в течение 5 минут заключительного периода реакции. Результаты эксперимента представить в виде 2 таблиц.
Поскольку цена одного деления шкалы Цельсия равна цене деления шкалы Кельвина, экспериментальные результаты определяются с помощью термометра, градуированного в градусах Цельсия ( ).
).
Таблица 1: Результаты измерения масс.
| Масса стакана m1, г | Масса стакана с мешалкой m2, г | Масса мешалки mмеш= m1- m2, г | Масса стакан с мешалкой и раствором щелочи, m3, г | Масса стакана после опыта, m4, г | Масса раствора после опыта mр=m4-m2,г | Масса раствора кислоты mк-ты = m4-m3,г |
Таблица 2: Результаты измерения температуры в ходе реакции.
| Время от начала опыта, мин | Предварительный период | Главный период | Заключительный период | |||||||||||
| 1,0 | 2,0 | 3,0 | 4,0 | 4,25 | 4,5 | 4,75 | 5,0 | 6,0 | 7,0 | 8,0 | 9,0 | |||
| Темпера- тура,oC |
Обработка результатов.
Изменение энтальпии реакции  рассчитывается по уравнению:
рассчитывается по уравнению:

Где Собщ- теплоемкость калориметрической системы,  ,
,  (С)- изменение температуры в ходе реакции,nк-ты- число молей эквивалентов кислоты в заданном объеме.
(С)- изменение температуры в ходе реакции,nк-ты- число молей эквивалентов кислоты в заданном объеме.
1.Теплоемкость калориметрической системы можно записать по приближенной формуле:
Cобщ=Cстакана +Cтермометра +Cмешалки + Сраствора.
Теплоемкостью термометра необходимо пренебречь, а теплоемкости остальных частей определить по формуле:
C = Cудm, где m – масса вещества, г, а Cуд- удельная теплоемкость вещества, 
При дальнейших расчетах возникают трудности, связанные с тем, что удельная теплоемкость в значительной мере зависит от состава. Теплоемкость дистиллированной воды составляет 4187 Дж/г∙К, но водные растворы неорганических соединений имеют теплоемкость от 2,9 до 3,9 Дж/г∙К. К тому же их теплоемкость зависит от их концентрации и температуры. Аналогично, учитывая, что стекло и сталь (мешалка), могут иметь различную теплоемкость в зависимости от состава (сорта), ниже при расчетах приведены усредненные значения Cуд.
Сстакана = С уд.стеклаm1; ( )
)
Cраствора = C уд. раствораmр-ра; ( )
)
Cмешалки = C уд. сталиmмеш.; ( ).
).
Изменение температуры в ходе реакции определить графически в соответствии с рис.3 на миллиметровой бумаге. На оси абсцисс отложить время в масштабе 1 мин = 1 см, на оси ординат- температуру, выбор масштаба которой зависит от величины  . При
. При  при
при  После того, как на график нанесены все экспериментальные точки, получается кривая ABCD. Участок АВ называется предварительным периодом, ВС- главным, СD- заключительным. Чтобы определить измерение температуры
После того, как на график нанесены все экспериментальные точки, получается кривая ABCD. Участок АВ называется предварительным периодом, ВС- главным, СD- заключительным. Чтобы определить измерение температуры  , не искаженное теплообменом, происходящим в течение главного периода, продолжить АВ и СD до пересечения с вертикальной прямой EF. Для этого точки mи n, соответствующие начальной и конечной температуре главного периода, нанести на ось ординат. Через середину отрезка mn провести линию КР. Пересечение этой линии с кривой ВС дает точку L, определяющую положение прямой EF. Отрезок EFи будет равен
, не искаженное теплообменом, происходящим в течение главного периода, продолжить АВ и СD до пересечения с вертикальной прямой EF. Для этого точки mи n, соответствующие начальной и конечной температуре главного периода, нанести на ось ординат. Через середину отрезка mn провести линию КР. Пересечение этой линии с кривой ВС дает точку L, определяющую положение прямой EF. Отрезок EFи будет равен  , отрезок mn=
, отрезок mn=  . Чем меньше температурный ход в предварительном и заключительном периоде, тем меньше потери теплоты за счет теплообмена и тем ближе
. Чем меньше температурный ход в предварительном и заключительном периоде, тем меньше потери теплоты за счет теплообмена и тем ближе  и
и  .
.
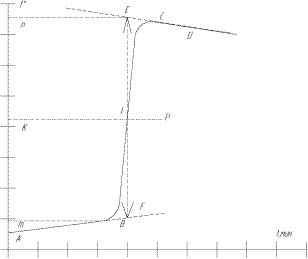
Рис. 3
2. Определить число молей кислоты в растворах

где mк-ты - масса раствора кислоты,  - эквивалентная концентрация кислоты (1 моль-экв/л или 2 моль-экв/л),
- эквивалентная концентрация кислоты (1 моль-экв/л или 2 моль-экв/л),  - плотность раствора кислоты(1,01 или 1,02
- плотность раствора кислоты(1,01 или 1,02  ).
).
3.Расчет погрешности эксперимента.
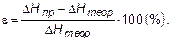
где 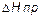 - экспериментально определенное значение энтальпии реакции;
- экспериментально определенное значение энтальпии реакции; 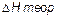 - теоретическое значение энтальпии реакции нейтрализации сильной кислоты сильным основанием. Нейтрализация моля эквивалентов любой сильной кислоты любым сильным основанием в разбавленных растворах всегда сопровождается одним и тем же экзотермическим эффектом, равным 55,8 кДж/моль. Этот факт теория электролитической диссоциации объясняет тем, что реакция нейтрализации сводится к образованию молекул воды:
- теоретическое значение энтальпии реакции нейтрализации сильной кислоты сильным основанием. Нейтрализация моля эквивалентов любой сильной кислоты любым сильным основанием в разбавленных растворах всегда сопровождается одним и тем же экзотермическим эффектом, равным 55,8 кДж/моль. Этот факт теория электролитической диссоциации объясняет тем, что реакция нейтрализации сводится к образованию молекул воды:
[H++ Cl-]+[Na++OH-]=[ Na++ Cl-]+H2O, т.е. H++OH-=H2O.
Для участников реакции H++OH-=H2O 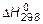 соответственно равны 0, -230,02 и -285,83 кДж/моль. По закону Гесса
соответственно равны 0, -230,02 и -285,83 кДж/моль. По закону Гесса 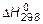 для реакции нейтрализации: -285,83+230,02=-55,8 кДж/моль.
для реакции нейтрализации: -285,83+230,02=-55,8 кДж/моль.
Главным фактором, определяющим точность результата, будет погрешность определения  (заведомое пренебрежение теплоемкостью термометра, изменяющейся теплоемкостью раствора в результате реакции и др.), т.к. ошибки взвешивания не превышают сотых долей процента.
(заведомое пренебрежение теплоемкостью термометра, изменяющейся теплоемкостью раствора в результате реакции и др.), т.к. ошибки взвешивания не превышают сотых долей процента.
Контрольные вопросы и задачи.
1. Вычислить тепловой эффект (изменение энтальпии) реакции
PbCO3 = PbO + CO2, если известны стандартные теплоты (энтальпии) образования участвующих в реакции веществ:


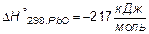
2. Обоснуйте и укажите знаки, 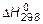
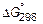 и
и 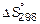 для:
для:
А)  протекающей при 298К в прямом направлении.
протекающей при 298К в прямом направлении.
Б) процесса испарения воды при 397К и давлении паров воды 101,325 кПа.
3. Вычислите величину энтальпии реакции (в стандартных условиях), в которой участвуют 12 литров метана: CH4(г) + CO2(г) = 2CO(г) + 2H2(г)
 ;
;  ;
;  .
.
4. Обоснуйте и укажите, какие из реакций образования оксидов азота и при каких температурах (высоких или низких) могут протекать самопроизвольно в стандартных условиях:

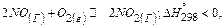

5. Как изменится энтропия системы при протекании в ней следующей реакции:  Дайте ответ, не производя вычислений.
Дайте ответ, не производя вычислений.
6. Исходя из значений соединений, участвующих в реакции, определить возможна ли эта реакция: Al2O3(кр)+3SO3(г)=Al2(SO4)3(кр).

Библиографический список
Коровин, Н.В. Общая химия. М.:Издательский центр «Академия»; 2013.496 c.
Химия. Учебник для вузов /А.А.Гуров, Ф.З.Бадаев, Л.П.Овчаренко, В.Н.Шаповал. М.: Издательский центр МГТУ им. Н.Э.Баумана,2004. 784 с.
Гольбрайх,З.Е., Маслов,Е.И.Сборник задач и упражнений по химии.М.: Издательская группа АСТ,2007.383 с.
Краткий справочник физико-химических величин /под ред. А.А.Равделя и А.М.Пономаревой; М.: ТИД «Аз-book»,2009.241с.
| <== предыдущая лекция | | | следующая лекция ==> |
| Аллотропные видоизменения углерода | | | Организация денежного обращения в Российской Федерации |
Не нашли, что искали? Воспользуйтесь поиском: