
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
ОКИСЛИТЕЛЬНО – ВОССТАНОВИТЕЛЬНЫЕ ПРОЦЕССЫ
Пример 1. Написать окислительно – восстановительную реакцию между KJи FeCl3и, использовать метод электронного баланса, подобрать коэффициенты к уравнению реакции.
Решение. При составлении уравнения окислительно – восстановительной реакции необходимо определить восстановитель и окислитель и число отдаваемых и принимаемых электронов. Коэффициенты подбирают, используя методы «электронного баланса» или «электронно – ионного баланса». Метод электронного баланса основан на сравнении степеней окисления элементов окислителя и восстановителя.
Для определение степени атомов элементов в химических соединениях необходимо пользоваться следующими правилами.
1. Кислород в большинстве соединений имеет степень окисления «-2», и, как исключение, в пероксидах «-1», а в соединениях с фтором «+2».
2. Для водорода наиболее характерна степень окисления «+1», а в гидридах щелочных т щелочноземельных металлов «-1».
3. В молекулах таких соединений, как Н2, O2, Cl2и других, степень окисления атомов равна нулю, так как здесь не происходит оттягивания общих электронных пар к какому – либо одному атому.
4. Алгебраическая сумма степеней окисления всех атомов, образующих данную молекулу, равна нулю, так как молекула электронейтральна, а данного иона равна заряду иона.
Составим уравнение окислительно – восстановительной реакции
KJ + FeCl3 → (3.1)
Прежде всего нужно определить, как пойдет реакция, какие продукты будут образовываться.
В молекуле KJкалий находиться в виде иона К+1, т.е. он уже окислен (отдал электрон), поэтому ион К+1 не может быть восстановителем. Йод в молекуле KJнаходится в виде иодид – иона J-, который, как и все галогенид – ионы, является сильным восстановителем и может а процессе реакции, отдавать электрон, окисляться до свободного йода.
В молекуле хлорного железа FeCl3железо находится в степени окисления «+3». Положительно заряженные ионы металлов, проявляющих переменную валентность, обладают окислительной способностью, т.е., принимая электроны, восстанавливаются, понижая при этом свою степень окисления.
Таким образом, продуктами окислительно – восстановительной реакции между KJи FeCl3будут J2и FeCl2. В реакции образуются также KClкак продукт параллельно идущей реакции обмена:
KJ + FeCl3 →J2 + FeCl2 + KCl. (3.2)
Напишем частные уравнения с участием электронов
Fe+3 + e- = Fe+2 (3.3)
2J-- 2e= J2
 Далее составляем схему электронного баланса, в соответствии с которой окислитель Fe+3примет, сколько электронов, сколько их отдаст J-, окислившись до J2, т.е. находим наименьшее общее кратное для схемы (3.3)
Далее составляем схему электронного баланса, в соответствии с которой окислитель Fe+3примет, сколько электронов, сколько их отдаст J-, окислившись до J2, т.е. находим наименьшее общее кратное для схемы (3.3)
Fe+3 + e- = Fe+2 2 (3.4)
2J-- 2e= J02 1
Суммируя оба уравнения с учетом найденных коэффициентов, имеем:
2Fe+3+2J- = 2Fe+2 + J2.
Найденные коэффициенты переносим в молекулярное уравнение, которое в окончательном виде можно записать следующим образом:
2FeCl3 + 2KJ→2FeCl2 + J2 + 2KCl (3.5)
Пример 2. Составить уравнение реакции
KMnO4+ Na2SO3 + H2SO4→
Коэффициенты подобрать методом электронно – ионного баланса.
Решение. В молекулу KMnO4входить перманганат – ион MnO-4, содержащий марганец в степени окисления «+7», который является очень сильным окислителем и, в зависимости от условий реакции может принимать различное число электронов, восстанавливаясь до степени окисления «+2» (в кислой среде), «+4» (в нейтральной среде) и «+6» (в щелочной среде). Естественно, что проявлять восстановительные свойства марганец в степень «+7» не может, так как он находится в максимальной степени окисления.
Сера в ионе SO-23находится в промежуточной степени окисления (S+4) и в зависимости от условий реакции может отдавать и принимать электроны. При взаимодействии с таким сильным окислителем, как перманганат калия KMnO4, ион SO-23будет проявлять восстановительные свойства, сера окисляться до степени окисления «+6», образуя ион SO-24.
В реакции участвует разбавленная серная кислота, которая не проявляет окислительных свойств и играет лишь роль среды, в которой протекает реакция:
KMnO4 + Na2SO3 + H2SO4→MnSO4 + Na2SO4 + K2SO4 + H2O. (3.6)
Для подбора коэффициентов в этом уравнении используем метод «электронно – ионного баланса».
Электронно – ионные уравнения отличаются от электроны уравнений тем, что в них записываю ионы или молекулы того состава, который отвечает их существованию в водном растворе с точки зрения теории электрической диссоциации. Электронно – ионные уравнения показывают переход электронов от ионов, молекул или атомов к другим с учетом характера среды (кислая, нейтральная, щелочная), в которой протекает рассматриваемая реакция.
При написании электрон – ионных уравнений для подсчета числа атома кислорода и водорода, входящих в состав окисляемых и восстанавливаемых молекул и ионов, вводят молекулы воды и ионы водорода Н+, если среда кислая, или молекулы воды и гидрокса – иона ОН-, если среда нейтральна или щелочная.
Таким образом, при написании электронно – ионных уравнений нужно исходить из состава ионов, действительно имеющих в растворе, а вещества малодиссоциирующие, плохо растворимые или газообразные следует писать в молекулярном виде.
Составим частные уравнения окисления и восстановления для рассмотренной реакции, учитывая формальное правило, заключающееся в том., что если кислородсодержащий ион переходит в бескислородный, например MnO-4→Mn+2, то высвобождающиеся при этом атомы кислорода связываются в воду при помощи ионов Н+:
MnO-4+ 8H+ →Mn+2 + 4H2O (3.7)
и наоборот, если ион восстановителя переходит в более богатый кислородом ион: SO-23→SO-24, то недостающие атомы кислорода берутся из воды, высвобождая при этом ионы водорода:
SO-23 + H2O→SO-24 + 2H+ (3.8)
Далее необходимо выполнить еще одно правило: суммарное число зарядов продуктов реакции должно быть равно суммарному числу зарядов исходных веществ.
С учетом этого уравнения 3.7 и 3.8 запишутся следующим образом:
MnO-4 + 8H+ + 5e- = Mn+2 + 4H2O (3.9)
SO-23+ H2O– 2e-= SO-24+ 2H+ (3.10)
Уравняем число отдаваемых и принимаемых электронов. Для этого левую и правую части уравнения (3.9) умножим на коэффициент 2, а левую и правую части уравнения (3.10) – на коэффициент 5:
MnO-4 + 8H+ + 5e = Mn+2 + 4H2O 2 (3.11)
 SO-23 + H2O – 2e = SO-24 + 2H+ 5 (3.12)
SO-23 + H2O – 2e = SO-24 + 2H+ 5 (3.12)
После умножения уравнений на соответствующие коэффициенты нужно сложить оба уравнения, сокращая одинаковые ионы и молекулы в левой и правой частях уравнения:
2MnO-4 + 6H+ + 5SO-23 = 2Mn+2 + 5SO-24 + 3H2O (3.13)
Уравнение (3.13) называется суммарным ионом уравнением данной окислительно – восстановительной реакции. Руководствуясь им, составляем итоговое молекулярное уравнение реакции:
2KMnO4 + 5Na2SO3 + 3H2SO4 = MnSO4 + 5Na2SO4 + H2O (3.14)
Пример 3. Использовать метод электронно – ионного баланса, составить уравнение следующей реакции:
KMnO4 + Na2SO3 + KOH→ (3.15)
Решение. В рассматриваемой реакции взаимодействуют те же исходные вещества, но уже в щелочной среде, поэтому они проявляют иные окислительно – восстановительные свойства. Продуктами реакции будут другие вещества.
В молекуле NaSO-23 ион SO-23 является восстановителем, как и в кислой среде, он отдает два электрона и переходит в ион SO-24. В молекуле KMnO4 ион MnO-4 также является окислителем, но в щелочной среде он, проявляя минимальную окислительную активность, принимает лишь один электрон и восстанавливается до иона MnO-24. Учитывая это, запишем в правой части уравнения (3.15) формула образующихся веществ:
KMnO4 + NaSO3 + KOH→K2MnO4 + Na2SO4 + H2O (3.16)
Составим электронно – ионные уравнения процессов окисления и восстановления, учитывая изменение кислородного состава ионов.
В данном случае в растворе существует ионы гидроксила ОН- и молекулы Н2О, поэтому, если бескислородный ион, атом или молекула переходят в кислородосодержащий или более кислородосодержащий ион, то недостающие атомы кислорода берутся из ионов ОН-. Таким образом, для реакции (3.16) будут иметь следующие электронно – ионные уравнения и восстановления:
MnO-4 + e- = MnO-24 2 (3.17)
 SO-23 + 2OH- - 2e = SO-24 + H2O
SO-23 + 2OH- - 2e = SO-24 + H2O
Суммарное ионное уравнение окислительно – восстановительной реакции будет иметь вид:
2MnO-4 + SO-23 + 2OH- = 2MnO-24 + SO-24 + H2O
Теперь запишем окончательное молекулярное уравнение окислительно – восстановительной реакции:
2KMnO4 + Na2SO3 + 2KOH→2K2MnO4 + Na2SO4 + H2O
Пример 4. Определить эквивалент KMnO4, реагирующего в качестве окислителя в кислой, нейтральной и щелочной среде.
Решение. Эквивалент вещества, участвующих в окислительно – восстановительных реакциях, рассчитывается – иначе, чем обычные химические эквиваленты.
Он определяется как частное от деления молекулярной массы вещества на число отданных или присоединенных элементов. Так как перманганат калия в различных средах восстанавливается по разному, то и его эквивалентная масса имеет различное значение в зависимости от рН среды.
Наиболее глубоко восстановление протекает в кислой среде:
MnO-4 + 8H+ + 5e = Mn+2 + 4H2O
В реакции участвует 5 электронов,эквивалент KMnO4 равен 1/5 молекулярной массы KMnO4:
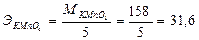
В нейтральной или слабощелочной средах KMnO4восстанавливается до MnO2по следующему уравнению:
MnO-4 + 2H2O + 3e- = MnO2 + 4OH-
Эквивалент KMnO4составляет 1/3 от молекулярной массы:

В сильнощелочной среде перманганат калия восстанавливается только до магната калия:
Эквивалент KMnO4 равен молекулярной массе, т.е. 158.
Пример 5. Рассчитать эквиваленты окислителя и восстановителя в следующей реакции:
5Ti2(SO4)3 + 2KMnO4 + 8H2SO4 = 10 Ti(SO4)2 + 2MnSO4 + K2SO4 + 8H2O
Решение. Определить элементы, изменившие степень окисления, и число электронов, отданные одной молекулой восстановителя и принятых одной молекулой окислителя:
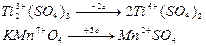
Эквивалент окислителя:
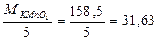
Эквивалент восстановителя:
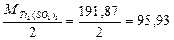
Пример 6. Вычислить нормальность раствора KMnO4, 20 мл которого прореагировали с 15 мл 2 н раствора восстановителя, если процесс восстановления KMnO4описывается следующим уравнением:
MnO-4 + 8H+ + 5e = Mn+2 + 4H2O
Сколько граммов KMnO4 вступило в реакцию?
Решение. В рассматриваемом примере грамм – эквивалент равен 1/5 моля, т.е. 158,5 = 31,6 г. Для определения нормальности раствора окислителя необходимо воспользоваться законом эквивалентов, согласно которому произведение объема раствора окислителя на его нормальность (число эквивалентов окислителя) равно произведению объема раствора восстановителя на его нормальность (число эквивалентов восстановителя):

Отсюда

Пример 7. Установить, в каком направлении возможно самопроизвольное протекание окислительно – восстановительной реакции:
FeCl3 + SnCl2 = SnCl4 + FeCl2
Решение. Для определения направления окислительно – восстановительного процесса необходимо рассчитать ЭДС (∆Е) этого процесса, которая равна разности между окислительно – восстановительным потенциалами предполагаемых окислителя и восстановителя:
∆Е = ЕОКИСЛ - ЕВОССТ
Если эта разность больше 0, то данная реакция осуществима; если эта разность меньше 0, то осуществима обратная реакция; если же эта разность равна 0, то имеет место химическое равновесие.
Уравнение реакции в ионной форме имеет вид:
Fe3+ + Sn2+ = Fe2+ + Sn4+
Запишем стандартные электродные потенциалы электрических систем, участвующих в реакции:
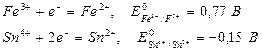
Так как

То, следовательно, окислителем будет ион Fe3+, а восстановителем – ион Sn2+.

Так как ∆E >0, то рассматриваемая реакция будет протекать слева направо.
Пример 8. Можно ли окислить в кислой среде бихроматом калия K2Cr2O7 следующие галогенид – ионы: F-, Cl-, Br-, J-?
Решение. Стандартные электродные потенциалы электрохимических систем, участвующих в реакции, будут:
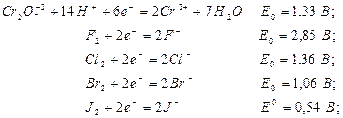
Для выяснения возможности использования K2Cr2O7в качестве окислителя определим ЭДС (∆Е0) следующих гальванических элементов:

Бихромат калия будет окислителем только в двух процессах:
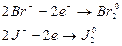
ЗАДАЧИ
1. Определить степень окисления азота в следующих соединениях: N2, N2O, NO, N2O3, NO2, N2O4, N2O5, NH3.
2. Определить степень окисления элементов в соединениях: K2S, CaH2, J2, NH4NO3, H2O2, K2Cr2O7, K2CrO4, K4[Fe(CN)6].
3. Какие из указанных веществ могут проявлять: только окислительные свойства; только восстановительные свойства; как окислительные, так и восстановительные:
а) KMnO4, MnO2, KJ;
б) PbO2, NH3, HNO2, Na2S;
в) Na2SO3, HNO3, K2Cr2O7.
4. Указать, какие из приведенных процессов представляет собой окисление, и какие восстановление. Написать уравнения этих процессов с помощью электронно – ионных реакций:
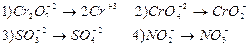
5. Учитывая степень окисления атомов элементов, оценить, не проводя расчета, возможность протекания окислено – восстановительных реакций между следующими веществами:
а) HNO3и P2O5;
б) HNO3и KClO4;
в) HBrO3и H3PO4;
г) HJи H2S;
д) NH3и HCl.
6. Определить коэффициенты электронно – ионные методом в следующих реакциях:
а) Cr2(SO4)3 + Br2 + NaOH→Na2CrO4 + NaBr + Na2SO4 + H2O;
б) K2Cr2O7 + FeSO4 + H2SO4→Cr2(SO4)3 + Fe2(SO4)3 + K2SO4 + H2O;
в) KMnO4 + H2O→KMnO4 + MnO2 + KOH;
г) HJ + H2SO4→J2 + H2S + H2O.
7. Определить коэффициенты методом электронного баланса в приведенных реакциях:
а) Na2MaO4 + HCl +Al→MaCl2 + AlCl3 + NaCl + H2O;
б) KMnO4 + H2O2 + H2SO4→MnSO4 + O2 + K2SO4 + H2O.
8. Напишите реакции взаимодействия: а) между углеродом и азотной кислотой, при этом углерод окисляется до СО2, а азотная кислота восстанавливается до NO; б) между йодистым водородом и перманганатом калия в сернокислой среде, при этом перманганат калия восстанавливается до сульфата марганца и выделяется элементарный йод. Для этих реакций составьте электронно – ионные уравнения и подберите коэффициенты.
9. Закончите управления реакций взаимодействия заданных веществ с азотной кислотой, имея в виду, что концентрированная HNO3восстанавливается до NO2, а разбавление – до NO. Составьте электронно – ионные уравнения и поберите коэффициенты:
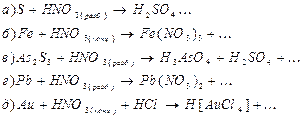
10. По приведенным ниже электронно – ионным схемам составьте уравнения окислительно – восстановительный реакций в молекулярном виде:
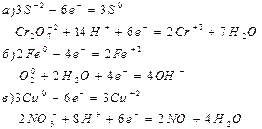
11. Чему равен грамм – эквивалент перманганата калия:
а) в кислой среде (KMnO4восстанавливается до Mn+2);
б) в щелочной среде (KMnO4восстанавливается до MnO4-2);
в) в нейтральной среде (KMnO4восстанавливается до MnО2).
12. Рассчитать эквиваленты окислителей и восстановителей в реакциях, протекающих по схеме:

13. Вычислить эквивалент перхлората калия (KClO4), если в реакции он восстанавливается:
а) до свободного хлора;
б) до хлорида калия;
14. Определить нормальность 0,1 м раствора нитрита калия, если он, является окислителем, восстанавливается до оксида азота (2) и, является восстановителем, окисляется до нитрата.
15. Сравнить окислительную СП способность следующих соединений железа (3): FeCl3, K[Fe(CN)6], Fe(OH)3, если FeCl3восстанавливается до FeСl2; K[Fe(CN)6] до K4[Fe(CN)6], aFe(OH)3 до Fe(OH)2. (Величины стандартных окислительно – восстановительных потенциалов возьмите из таблицы).
16. Может ли перманганат калия окислить в кислой среде Cr+3до Cr2O7+2? (См. ту же таблицу.)
17. Проанализировать возможность взаимодействия ионов ClO-4и
MnO-4; ClO-3и MnO-4в кислой среде (см. ту же таблицу.)
| Уравнения полуреакции | Е0, В |
| Fe(OH)3 + e- = Fe(OH)2 + OH- | - 0,56 |
| CrO4-2 + 2H2O + 3e- = CrO-2 + 4OH- | - 0,21 |
| Sn+4 + 2e = Sn+2 | - 0,15 |
| [Fe(CN)6]-3 + e- = [Fe(CN)6]-4 | 0,36 |
| ClO4- + H2O + 2e- = ClO3- + 2OH- | 0,36 |
| J2 + 2e- = 2J- | 0,54 |
| Fe+3 + e- = Fe+2 | 0,77 |
| NO3- + 2H+ = NO2 + H2O | 0,80 |
| NO3- + 3H+ + 2e- = HNO2 + H2O | 0,94 |
| Br2 + 2e- = 2Br- | 1,06 |
| MnO2 + 4H+ + 2e- = Mn+2 + 2H2O | 1,22 |
| Cr2O7-2 + 14H+ + 6e- = 2Cr+3 + 7H2O | 1,33 |
| Cl2 + 2e- = 2Cl- | 1,36 |
| 2ClO4- + 16H+ + 14e- = Cl2 + 8H2O | 1,39 |
| 2ClO3- + 12H+ +10e- = Cl2 + 6H2O | 1,47 |
| MnO4- + 8H+ + 5e- = Mn+2 + 4H2O | 1,52 |
| PbO2 +SO4-2 + 4H+ +2e- =PbSO4+ 2H2O | 1,69 |
| H2O2 + 2H+ + 2e- = 2H2O | 1,77 |
| CO+3 + e- = CO+2 | 1,84 |
| F2 + 2e- = 2F- | 2,85 |
18. Может ли концентрированная азотная кислота окислить:
1) ион Cr+3 до ионов Cr2O7-2;
2) ион Pb+2 до PbO2;
3) ион Sn+2 до иона Sn+4?
Кислота при этом восстанавливается до NO2.
19. Пользуясь значениями стандартных окислительно – восстановительных потенциалов, определить направление следующих окислительно – восстановительных реакций:
а) 5Fe+2 + MnO4- + 8H+ ↔ 5Fe+3 + Mn+2 + 4H2O;
б) 5Co+2 + MnO4- + 8H+ ↔ 5Co+3 + Mn+2 +4H2O.
20. Какой из окислителей: MnO2, K2Cr2O7 – является наиболее эффективным по отношению к HCl с целью получения из нее свободного хлора?
21. Можно ли при стандартных условиях окислить в щелочной среде Fe+2 в Fe+3 c помощью хрома калия. Восстановление CrO4-2 до CrO2- протекает по схеме:
CrO4-2 + 2H2O + 3e- = CrO2- + 4OH-.
22. В каком направлении протекает реакция в кислой среде между KClO3 и MnO2:
MnO2 + ClO3- + 2H+ ↔ Mn+2 + ClO4- + H2O.
23. Можно ли использовать KMnO4 в качестве окислителя в кислой среде в следующих процессах при условиях:
а) HNO2 + H2O – 2e- = NO3- + 3H+;
б) 2H2O – 2e- = H2O2 + 2H+.
24. Можно ли использовать в кислой среде PbO2 в качестве окислителя для осуществления в стандартных условиях следующих реакций:
а) Mn+2 + 4H2O – 5e- = MnO4- + 8H+;
б) Co+2 – e- = Co+3;
в) 2Cr+3 + 7H2O – 6e- = Cr2O7-2 + 14H+.
Не нашли, что искали? Воспользуйтесь поиском: