
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
ХИМИЧЕСКАЯ КИНЕТИКА
4.1. Зависимость скорости химической реакции
от концентрации. Константа скорости
Пример 1. Написать выражение скорости по закону действия масс для реакций:
а) NO(Г) + Cl2(Г) = NOCl2(Г);
б) H2(Г) + Cl2(Г) = 2HCl(Г).
Решение. По закону действия масс: «При постоянной температуре скорости химической реакции прямо пропорциональна произведению концентрации реагирующих веществ в степени их стехиометрических коэффициентов» для реакции, протекающей по уравнению:
a A + b B = c C, получим U = K[A]a [B]b, (4.1)
где U – скорость химической реакции;
K – стехиометрические коэффициенты.
[A], [B] – концентрация вещества А и В, моль/л;
a,b – стехиометрические коэффициенты.
Тогда для первой реакции выражение скорости:
U1 = K1[NO][Cl2];
для второй:
U2 = K2[H2][Cl2].
Пример 2. Найти значение константы скорости реакции А(Г) + В(Г) = АВ(Г), если при концентрациях веществ А и В, равных соответственно 0,05 и 0,01 моль/л, скорость реакции равна 0,0005 моль/л с.
Решение. Скорость реакции U = K[A][B], откуда константа скорости будет:

Константа скорости К равна 1 л∙с-1 моль-1.
Пример 3. В системе CO(Г) + Cl2(Г) ↔ CoCl2(Г) концентрацию СО увеличить от 0,03 до 0,12 моль/л, а концентрацию хлора – от 0,02 до 0,06 моль/л. Во сколько раз возросла скорость прямой реакции?
Решение. Зависимость скорости реакции от концентраций участвующих в реакции веществ выражаются уравнением U = K[CO][Cl2],
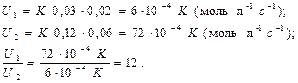
Скорость реакции возросла в 12 раз.
Пример 4. Реакция между веществами А и В выражается уравнением
А + 2В →С. Начальные концентрации составляют [A] = 0,03 моль/л, [В] = 0,05 моль/л. Константа скорости равна 0,4. Найти начальную скорость реакции U1 и скорость реакции U2 по истечении некоторого времени, когда концентрация вещества А уменьшается на 0,01 моль/л.
Решение. Выражение для скорости реакции запишется следующим образом: U = K[A][B]2.
Начальная скорость реакции:
U1 = 0,4∙0,03∙0,052 = 3∙10-5 моль л-1 с-1.
По истечении некоторого времени концентрация вещества А равна
0,03 – 0,01 = 0,02 моль/л.
Как видно из уравнения реакция при её протекании, 1 моль вещества А реагирует с двумя молями вещества В.
Тогда на 0,01 моль/л вещества А будет израсходовано 0,02 моль/л вещества В. Поэтому по истечении некоторого времени концентрация вещества А будет 0,02 моль/л, а вещества В 0,05 – 0,02 = 0,03 моль/л. Следовательно, скорость реакции U2,будет равна:
U2 = 0,4∙0,02∙0,032 = 7,2∙10-6 моль л-1 с-1.
Пример 5. Как изменится скорость реакции H2(Г) + Cl2(Г) → 2HCl(Г), если увеличить давление в системе в 2 раза?
Решение. Кинетическое уравнение для данной реакции U1 = K[H2][Cl2].
При увеличении давления в системе концентрации всех участков реакции возрастут в 2 раза, поэтому:
U2 = K[2H2][2Cl2] = 4K[H2][Cl2] = 4U1.
Пример 6. Вычислить равновесные концентрации водорода и йода и рассчитать константу равновесия, если известно, что начальные концентрации исходных веществ были равны и составляли 0,02 моль/л, а равновесная концентрация HJ равна 0,03 моль/л.
Решение. Из уравнения реакции H2(Г) + J2(Г) ↔ 2HJ(Г) видно, что на образование 0,03 моля HJ расходуется 0,015 моля водорода и столько же йода. Следовательно, их равновесные концентрации составляют 0,02 – 0,015 моль/л. Константа равновесия может быть выражена следующим образом через равновесные концентрации:

Подставив значения концентраций компонентов, получим:

Пример 7. Константа равновесия системы H2(Г)+ J2(Г) ↔ 2HJ(Г)при некоторой температуре равна 40ю Определить, какой процент этих веществ одинаковы и составляют 0,01 моль/л.
Решение. Выразим равновесные концентрации веществ через исходные. Для этого обозначим уменьшение концентрации водорода и йода к моменту равновесия через х. Следовательно, равновесные концентрации составят: [J2] = (0,01 - x) моль/л, [HJ] = 2xмоль/л. Для определения х подставим числовые значения равновесных концентраций в выражение константы равновесия:

Уравнение имеет два корня: х1 = 0,0146 и х2 = 0,0076. Из двух значений х следует выбрать то, которое отвечает условию задачи. Исходные концентрации водорода и йода равна 0,01 моль/л. Следовательно, х не может иметь значения больше 0,01 и решение имеет один корень – 0,0076 моль/л. Таким образом, из 0,01 моля водорода и 0,01 моля йода прореагировало по 0,0076 моля, что составляет:

ЗАДАЧИ
1. Написать выражение скорости по закону действия масс для реакций, протекающих между:
а) азотом и кислородом;
б) водородом и кислородом;
в) оксидом азота (2) и кислородом.
2. Написать выражение скорости химической реакции, протекающей в гомогенной системе по уравнению А(Г) + 2В2(Г) = АВ2(Г) и определить, во сколько раз увеличить скорость реакции, если:
а) концентрации А увеличится в 2 раза;
б) концентрация В увеличится в 2 раза.
3. Во сколько раз следует увеличить концентрацию оксида углерода (2) в системе 2СО(Г) = СО2(Г) + С(Тв), чтобы скорость реакции увеличилась в четыре раза?
4. Написать уравнение скорости реакции С(Тв) + О2(Г) = СО2(Г) и определить, во сколько раз увеличится скорость реакции при увеличении кислорода в три раза.
5. Найти значение константы скорости реакции А(Г) + В(Г) →АВ(Г), если при концентрациях вещества А и В, равных соответственно 0,5 и 0,1 моль/л, скорость реакции равна 0,005 моль л-1 мин-1.
6. Во сколько раз изменится скорость реакции 2А(Г) + В(Г)→ А2В(Г), если концентрацию вещества А увеличить в 2 раза, концентрацию вещества В уменьшить в 2 раза?
7. При некоторой температуры равновесные концентрации в системе 2SO2(Г) + О2(Г) ↔ 2SO3 составляли соответственно [SO2] = 0,04 моль/л, [O2] = 0,06 моль/л, [SO3] = 0,02 моль/л. Вычислить константу равновесия и исходные концентрации диоксида серы и кислорода.
8. Вычислить константу равновесия системы COCl2(Г)↔СО(Г) + Cl2(Г), если при некоторой температуре равновесные концентрации оксида углерода и хлора в системе равны и составляют 0,001 моль/л, а [COCl2] = 4,65∙10-5 моль/л.
9. Исходные концентрации оксида азота (2) и хлора в системе 2NO(Г) + Cl2↔ 2NOCl(Г) составляют соответственно 0,5 моль/л и 0,2 моль/л. Вычислить константу равновесия, если к моменту наступления равновесия прореагировало 20% оксида азота.
10. Определить равновесную концентрацию водорода, а системе
2HJ(Г) ↔H2(Г) + J2(Г), если исходная концентрация HJ составляла 0,05 моль/л, а константа равновесия К = 0,02.
11. Константа равновесия реакции FeO(Кр) + СО(Г) ↔Fe(Кр) + СО2(Г) при некоторой температуре равна 0,5. Найти равновесные концентрации СО и СО2, если начальные концентрации этих веществ составляли [CO] = 0,05 моль/л, [CO2] = 0,01 моль/л.
12. Равновесие в системе H2(Г) + J2(Г)↔ 2HJ(Г) установилось при следующих концентрациях: [H2] = 0,25 моль/л, [J2] = 0,05 моль/л, [HJ] = 0,9 моль/л. Определить исходные концентрации йода водорода.
13. Найти константу равновесия реакции N2O4(Г)↔ 2NO2(Г), если начальная концентрация [N2O4] составляла 0,08 моль/л, а к моменту наступления равновесия продиссоциировано 50% N2O4.
14. Константа равновесия реакции А(Г) + В(Г)↔ С(Г) + D(Г) равна единице. Начальная концентрация [A] = 2 моль/л. Сколько процентов
вещества А подвергается превращению, если начальные концентрации [B] равны:
а) 2 моль/л,
б) 10 моль/л,
в) 20 моль/л.
15. Реакция между веществами А и В протекает по уравнению
А(Г) + 2В(Г) →С(Г). Концентрация вещества А равна 1,5 моль/л, а В – 3 моль/л. Константа скорости реакции 0,4. Вычислить скорость химической реакции в начальный момент времени и по истечении некоторого времени, когда прореагирует 75% А.
16. Реакция между веществами А и В выражается уравнением
А(Г) + 2В(Г) →С(Г). Начальные концентрации составляют: [A]0 = 0,3 моль/л, [B] = 0,5 моль/л. Константа скорости 0,4. Найти начальную скорость реакции и скорость по истечении некоторого времени, когда концентрация А уменьшится на 0,1 моль/л.
17. Как изменится скорость реакции 2NO(Г) + O2(Г) → 2NO2(Г), если:
1) увеличить давление в системе в 3 раза,
2) уменьшить концентрацию NO в 2 раза?
18. Как изменится скорость реакции 2H2(Г) + О2(Г) → 2Н2О(Г), если:
1) увеличить давление в системе в 2 раза,
2) уменьшить концентрацию О2 в 4 раза?
4.2. Порядок реакции. Период полураспада
Пример 1. Скорость реакции в растворе
3ОС2Н5ОН + В10Н14 = 10В(ОС2Н5)3 + 22Н2(Г)
описывается уравнением:
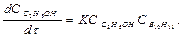
Каков порядок реакции?
Решение. Порядок реакции определяется суммой показателей степеней при концентрации в дифференциальном уравнении скорости. Если сумма равна 1, то реакцию называют реакцией первого порядка, если 2 – второго, если 3 – третьего. Различают полный и частный порядок реакции. Каждый из показателей степени при концентрациях в дифференциальном уравнении скорости порядок реакции по данному веществу. Сумма показателей степени при концентрациях определяется полный порядок реакции.
Стехиометрические коэффициенты в уравнении не отражают истинный механизм реакции и не определяют порядок реакции (определяют порядок реакции коэффициенты в дифференциальном уравнении скорости). В данной реакции частный порядок по компоненту С2Н5ОН равен единице, частный порядок по компоненту В10Н14 равен единице, общий порядок равен сумме частных порядков, т.е. двум.
Пример 2. Реакция каталитического разложения перекиси водорода в водном растворе протекает как реакция первого порядка. Период полураспада при данных условиях равен 15,86 мин. Определить, какое время потребуется при этих условиях для разложения 99% перекиси водорода.
Решение. Для вычисления константы скоростей реакции первого порядка можно воспользоваться уравнением
 (4.2)
(4.2)
Где К – константа скорости; τ – время от начала реакции; С0 – начальная концентрация реагирующего исходного вещества; СХ – концентрация прореагировавшего вещества за истекший промежуток времени.
Для реакции первого порядка время превращения половины (или определенной доли) вещества не зависит от начальной концентрации.
При  (время полураспада)
(время полураспада)
 (4,3)
(4,3)
По периоду полураспада, используя уравнение (4.3), вычисляем константу скорости разложения перекиси водорода:

Зная константу, по формуле (4.2) определим время. За которое разложится 99% перекиси водорода:

Пример 3. Для изучения разложения щавелевой кислоты в концентрированной серной кислоты при 50 0С готовили раствор, щавелевой кислоты в 99,5% - ной серной кислоты с концентрацией 1/40 м. Через определенные промежутки τ из смеси отбирали пробы, титровали их раствором KMnO4, определяли объем раствора Uперманганата калия, необходимым для титрования порции в 10 мл. Получены следующие данные:
τ, мин 0 120 240 420;
U, мл 11,45 9,63 8,11 6,22.
Определить порядок реакции относительно щавелевой кислоты и среднюю константу скорости.
Решение. Предположим, что реакция имеет первый порядок. Тогда по уравнению (4.2) имеем:

Через120 мин С0 – СХ = 9,63 мл;

Через 240 мин С0 – СХ = 8,11 мл;

Через 420 мин С0 – СХ = 6,22 мл;

Средняя константа будет:

Таким образом, реакция имеет первый порядок относительно щавелевой кислоты, так как константа сохраняет постоянное значение 0,00144, 0,00144, 0,00145 мин-1.
Пример 4. Скорость реакции (С2Н5)3N+ CH3J→[(C2H5)3 – N++ (CH5)]J-
τ, с 1200 1800 2400;
СХ моль/л 0,00876 0,01066 0,01208.
Здесь τ – время, СХ – количество триэтиламина (С2Н5)3Nили йодистого метила CH3J, прореагировавшего за время τ. Начальные концентрации амина и йодистого метила равна 0,0198 моль/л. Рассматриваемая реакция – реакция второго порядка. Определить среднюю константу скорости.
Решение. Для реакции второго порядка константу скорости можно рассчитать по уравнению:
 (4.4)
(4.4)
где К – константа скорости реакции; τ – время от начала опыта; С0,А – начальная концентрация первого вещества; С0,В – начальная концентрация второго вещества; СХ – количество вещества, вступившее в реакцию к моменту времени τ от начала опыта.
Так как С0,А = С0.В, то уравнение (4.4) упрощается и принимает вид:

Рассчитаем константы К при τ = 1200 сек, τ = 1800 сек, τ = 2400 сек и вычислим среднее значение её значение:

Средняя константа
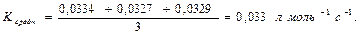
ЗАДАЧИ
19. Разложение перекиси водорода в водном растворе подчиняется закону реакции первого порядка. Константа скорости этой реакции равна 0,05081 мин-1. Определить время, за которое произойдет разложение 50 и 99,9% Н2О2.
20. Константа распада RaAравна 3,79∙10-3 с-1. Определить период полураспада и время, за которое ради распадается на 90%.
21. В течение часа подвергается распада 1/6 части некоторого радиоактивного элемент. Определить период полураспада его.
22. В сосуде имеется 0,025 г радона. Период полураспада радона равен 3,82 дня. Какое количество радон (%) остается в сосуде через 14 дней?
23. Имеется 5 мг радия, период полураспада которого равен 19,7 мин. Какое количество радия останется через 2,5 часа?
24. Концентрация атома трития 3Т в воздухе 5∙10-15 моль/л, период полураспада трития около 12 мин. Через сколько лет распадется 90% трития, содержащегося в воздухе? (Пополнение содержания трития за счет ядерных процессах не учитывать).
25. Через какое время активность актиния составит 40% от первоначальной, если период полураспада его 36,1 мин?
26. При гидролизе тростникового сахара
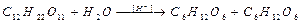
начальная концентрация сахара C12H22O11 была равна 2∙10-2 моль/л. Через 5 мин она стала равна 1,8∙10-2 моль/л, через 10,18 мин – 1,6∙10-2 моль/л. Определить среднюю константу скорости гидролиза. Почему эту реакцию можно считать реакцией первого порядка?
27. Во сколько раз возрастает скорость реакции разложения N2O5по суммарной реакции:
2N2O5(Г)= 2N2O4(Г)+ О2(Г)
при увеличении концентрации N2O5в 2 раза, если известно, что реакция идет по стадиям:
N2O5= N2O3 + O2 (медленная);
N2O3= NO2+ NO (быстрая);
NO + N2O5 = 3NO2 (быстрая);
2NO2 = N2O4 (быстрая);
28. Константа скорости растворения PbCl2в воде при стандартной температуры равна 0,016 мин-1. Растворимость этой соли равна 3,6∙10-2 моль/л. Определить концентрацию соли в растворе через 1 час после начала растворения.
29. Предполагают, что распад озона по уравнению реакции 2О3(Г) = 3О2(Г) протекает через стадии:
1) О3 = О2 + О (быстрая);
2) О + О3 = 2О2 (медленная).
Каков вид кинетического уравнения скорости? Какой порядок реакции?
30. Кинетическое уравнение реакции в растворе:

имеет вид:

Как изменится скорость реакции при увеличении рН раствора на единицу?
31. Реакция:
С2Н4Br2+ 3KJ= C2H4+ 2HBr+ KJ3
ускоряется в 3 раза при увеличении конденсации С2H4Br2в 3 раза, и в 4 раза при увеличении концентрации KJв 4 раза. Напишите уравнение скорости реакции. Каков порядок реакции?
32. При разложении перекиси водорода начальная концентрация была равна 2∙10-3 моль/л. Через 6 минут она стала равна 1,85∙10-3 моль/л, через 12 – 1,8∙10-3, через 30 мин – 1,5∙10-3 моль/л. Определить среднюю константу скорости реакции. Какой порядок реакции?
33. При гидролизе сложного эфира – этилацетата реакция идет по уравнению СН3СООС2Н5 + Н2О = СН3СООН + С2Н5ОН. Начальная концентрация эфира была равна 2,5∙10-3 моль/л. Через 5 мин – 2,3∙10-3 моль/л, через 8 мин – 2,2∙10-3 моль/л, через 19,5 мин – 1,8∙10-3 моль/л. Определить среднюю константу скорости гидролиза. Почему реакцию гидролиза можно считать реакцией первого порядка?
34. Реакция гидролитического разложения сахара:
С12Н22О11 + Н2О = С6Н12О6 +С6Н12О6
глюкоза фруктоза
Определить среднюю константу скорости, если через 1435 мин от начала реакции отношение начальной концентрации С0 к концентрации в данный момент С будет:
 ,а через 4315 мин
,а через 4315 мин  .
.
Почему инверсия сахара проходит как реакция первого порядка?
35. При разложении щавелевой кислоты в концентрированной серной кислоте при 50 0С готовили 0,025 м раствор щавелевой кислоты в 99,5% - ной серной кислоте. Через определенные промежутки времени τ из смеси отбирали пробы и определяли объем Uраствора пергамента калия, необходимый для титрования порция в 10 мл:
τ, мин 0 600 900 1440;
U, мл 11,45 4,79 2,97 1,44.
Порядок реакции – первый. Рассчитайте среднюю константу скорости.
36. Скорость реакции:
(С2Н5)3N+ CH3J→[(C2H5)3 – N+- (CH3)]J-
определялось при 250С, причем найдено, что
τ, с 3600 4500 5400;
Сх, моль 0,01392 0,01476 0,01538.
Здесь τ – время, Сх – количество триэтиламина или йодистого метила, прореагировавшее за время τ. Начальные концентрации амина и йодистого метила равна 0,0198 моль/л. Определить среднюю константу скорости по уравнению для реакции второго порядка.
37. Разложение N2O5является реакцией первого порядка, константа скорости которой равна 0,002 мин-1. Определить, сколько процентов N2O5 разложится за 2 часа.
38. Реакция самоокисления – самовосстановления гипобромид – ионов в щелочной среде 3BrO-= BrO3-+ 2Br-является реакцией второго порядка.
Константа её скорости равна 9,3∙10-4 м3 (кмоль с)-1. Начальная концентрация гипобромид – иона равна 0,1 кмоль/м3. Найти время, за которое прореагирует 25% исходного количества BrO-.
39. Разложение перекиси протекает по уравнению:

Начальная концентрация перекиси 5∙10-2 моль/л. Через 10 мин. концентрация уменьшилась до 4∙10-2 моль/л, через 15 минут – до 3∙10-2 моль/л, через 30 минут – до 5∙10-2 моль/л. Через 40 минут – до 2∙10-2 моль/л. Постройте график в координатах lgCτ= f(τ). Найдите константу скорости, равную К = 2,3 tgά, где ά – угол наклона прямой.
40. В разбавленном водном растворе реакция гидратации уксусного ангидрида протекает как реакция первого порядка:
(СН3СО)2О + Н2О = 2СН3СООН.
Начальная концентрация уксусного ангидрида равна 3∙10-3 моль/л. Через 1 мин. – 2,94∙10-2, через 2 мин. – 2,12∙10-2 моль/л, через 3 мин. – 1,79∙10-2 моль/л. Постройте график в координатах lgCτ= f(τ). Рассчитайте константу скорости К = 2,3 tgά.
4.3. Зависимость скорости реакции от температуры.
Энергия активации
Пример 1. При 800С некоторая реакция заканчивается за 16 мин. Принимая температурный коэффициент γ равным 2, рассчитать, через какое время закончится реакция при температуре 1200С.
Решение. Зависимость скорости реакции (или константы скорости реакции) от температуры определяют исходя из правила Вант – Гоффа, согласно которому при повышении температуры на 100 скорость реакции возрастает в 2 – 4 раза, т.е.
 (4.5)
(4.5)
где γ – температурный коэффициент скорости реакции, значение которого для большинства реакций лежит в пределах 2 – 4; КТ1, КТ2 – константа скорости реакции при начальной и конечной температуры Т1 и Т2; UT1, UT2– скорости реакции при температуре Т1 и Т2:
Т1 = 273 + 80 = 353 К;
Т2 = 273 + 120 = 393 К, далее 
Таким образом, скорость реакции при увеличении температуры на 400С возрастает в 16 раз. Поэтому время, за которое будет протекать реакция,

Пример 2. Во сколько раз возрастет скорость реакции при повышении температуры от 200С до 300С, если энергия активации равна 125400 Дж/моль.
Решение. Зависимость скорости К от температуры Т описывается уравнением Аррениуса:
 (4.6)
(4.6)
где К – константа скорости; Т – температура, К; Еа – энергия активации; R– газовая постоянная.
Интегрируя уравнение (4.6) в переделах от Т1 до Т2, получим:
 (4.7)
(4.7)
Переходя десятичным и подставляя численное значение газовой постоянной и температуры, получим:

Пример 3. Энергия активации некоторой реакции в отсутствие катализатора равна 75,24 кДж/моль, а с катализатором – 50,14 кДж/моль. Во сколько раз возрастает скорость реакции в присутствии катализаторов, если реакция протекает при 250С?
Решение. Обозначим энергию активации некоторой реакции в отсутствие катализатора через Еа, а с катализатором через Ea’; соответствующие константы скорости обозначим через К и К’. Используем Аррениуса в экспоненциальной форме:
 (4.8)
(4.8)
Где k– константа скорости; А – предэкспоненциальный множитель; е – основание натуральных логарифмов (е = 2,718); R– универсальная газовая постоянная; Т – температура, К.
Тогда отношение констант скоростей запишется

Пример 4. Реакция термического разложения газообразной окиси этилена при 378,50С протекает по закону реакций первого порядка. Период полураспада при этой температуре равна 363 мин. Энергия активации 217,0 Дж/моль. Определить константу скорости реакции при 4500С.
Решение. По уравнению (4.3) вычисляем константу скорости при температуре Т1 = 378,5 + 273 = 651,5 К:

По уравнению (4.7) вычисляем константу скорости при температуре Т2 = 450 + 273 = 723 К.
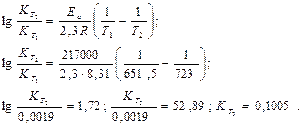
ЗАДАЧИ
41. Две реакции протекает при 250С с одинаковой скоростью. Температурный коэффициент скорости первой реакции равен 2,0, а второй – 2,5. Найти отношение скорости этих реакций при 950С.
42. Чему равен температурный коэффициент скорости реакции, если при увеличении температуры на 30 градусов скорость реакции возрастает в 15,6 раза?
43. Во сколько раз увеличится константа скорости химической реакции при повышении температуры на 400С, если γ = 3,2?
44. На сколько градусов следует повысить температуру системы, чтобы скорость протекающей в ней реакции возросла в 30 раз (γ = 2,5)?
45. Вычислить γ реакции, если константа скорости её при 1200С составляет 5,88∙10-4, а при 1700С равна 6,7∙10-2.
46. Во сколько раз возрастает скорость реакции при повышении температуры от 300С до 400С, если энергия активации 125400 Дж/моль?
47. Константа скорости некоторой реакции при 200С равна 3∙10-2, а при 500С - 4∙10-1. Определить энергию активации.
48. Константа скорости разложения двуокиси азота
2NO2= 2NO+ O2
при 6000К равна 8,4∙101 л моль-1 с-1, а при 6400С равна 4,2∙102л моль-1 с-1. Вычислить энергию активации.
49. При 170С сердце лягушки совершает 30 сокращений в 1 мин, а при 270С – 60 сокращений в мин. Вычислить энергию активации сокращения сердечной мышцы лягушки.
50. Чему равна энергия активации реакции, если при повышении температуры от 290 до 300К скорость её увеличится в 2 раза?
51. Каково значение энергии активации реакции, скорости которой при 300К в 10 раз больше, чем при 280К?
52. Существует мнение, что скорость обычной химической реакции удваивается при увеличении температуры на 10 градусов. Определить энергию активации Еа реакции, для которой это утверждение приемлемо вблизи 300К.
53. Скорость реакции N+ O2= NO+ Oв газовой фазе изучалась при получении атома в простой системе в высокочастотном разряде, причем концентрация определялась методом ЭПР. Найдены следующие константы скорости:
Т, К 586 910
К, мл моль1 с-1 (1,63±0,05) 1010 (1,77±0,08) 1011
Определить два значения энергии активации, соответствующие верхнему и нижнему пределам, с учетом ошибок, указанных в экспериментальных данных.
54. Две реакции одинакового порядка имеют одинаковые предэкспоненциальные множители, но их энергии активации различаются: Е2 – Е1 = 83,196 кДж/моль. Рассчитайте отношение их констант скоростей К1/К2 при 434К.
55. Константа скорости омыления этилацетата едким натром при 90С равна 2,37, а при 14,40С – 3,204. Рассчитать температурный коэффициент скорости реакции в указанных пределах температур и энергию активации.
56. Константа скорости омыления уксусного – этилового эфира едким натром при 9,40С равна при 2,37, а при 14,40С - 3,204. Вычислить, при какой температуре константа скорости будет равна 15.
57. Для реакции разложения паров уксусного альдегида константа скорости при 4600С равна 0,035, а при 5180С – 0,343 (концентрация выражена в моль/л, а время – в секундах). Определить энергию активации данной реакции и константу скорости её при 4860С.
58. Константа скорости реакции инверсии тростникового сахара при 250С равна 9,67∙10-3, а при 400С – 73,4·10-3. Определить энергию активации данной реакции в указанном интервале температур.
59. Для реакции разложения паров уксусного альдегида константа скорости при 4600С равна 0,035, а при 5180С – 0,343 (концентрация выражена в моль/л, а время в секундах). Определить энергию активации данной реакции и константу скорости её при 4860С.
60. Для прямой и обратной реакции в системе
2HJ(Г)↔ H2(Г)+J2(Г)
Известны константы скорости прямой и обратной реакций при температуре 556 К:
Кпр.(моль-1 л с-1) и Кобр.(моль-1 л с-1)
3,52·10-7 4,44∙10-5;
и при температуре 575 К:
Кпр.(моль-1 л с-1) и Кобр.(моль-1 л с-1)
1,22·10-6 1,32∙10-4.
Вычислить:
1) энергию активации примой Епр. и обратного Еобр. процессов;
2) тепловой эффект реакции ∆Н как разность Епр. и Еобр.;
3) константу равновесия.
61. По значениям констант скорости реакции, измеренных при трех температурах, определить энергию активации процесса гидролиза эфира. Постройте график в координатах lgK = f(1/T). Рассчитайте энергию активации, как Еакт. = 2,3 Rtgά.
Температура 25 35 45;
0С
Константа
скорости К (мин-1) 4,6·10-3 6,7∙10-3 1,4·10-2.
62. Константа скорости разложения NCl меняется с температурой следующим образом:
t, 0C 25 35 45;
К (мин-1) 0,0093 0,0222 0,0530.
Построить график в координатах lgK = f(1/T) и рассчитайте энергию активации как Еакт. = 2,3 Rtgά.
63. Константа скорости разложения N2O5 равна при 250С 3,46∙10-5 с-1, при 350С – 4,98∙10-4с-1. Постройте график в координатах lgK = f(1/T) и рассчитайте энергию активации, как Еакт. = 2,3 tgά.
ОТВЕТЫ
Глава 1.
1. 746 мл; 2. 303900 Па; 3. 4,8 л; 4. 1,8 м3; 5. 44 мл; 6. 100800 Па; 7. РН2 =27700 Па, РСН4 = 80000 Па, Робщ. = 1077,00 Па; 8. 34,0% NO; 66,0% CO; 9.  11. 2,69∙10-19; 12. 1 л; 14. 43 л; 15. 33,6 л; 16. 54800 Па; 17. не изменится; 18. 1,2 кг/м3; 19. 26,0 г; 20. 28 г, 4,65·10-23; 21. 47 г; 1,62; 22. 28 а.е.м.; 23. 58 г; 24. 820 мл; 25. 125000 Па; 26. 1 кг; 27. 0,214 кг. 28. в 1,03 раз; 29. 9,01; 30. 127; 31. 10 л; 32. 12,14; 33. 56,2; 34. ЭBr2 = 79,911, ЭМе = 9; 35. 32,69; 36. 1,76 г; 37. Эок = 24, ЭМе = 16; 38. ЭМе = 56,2, UH2 = 3,36 л; 39. 54,2; 40. 15 г и 24,9 г; 41. 2,8 л; 42. 3; 6; 12; 43. 28; 44. Al.
11. 2,69∙10-19; 12. 1 л; 14. 43 л; 15. 33,6 л; 16. 54800 Па; 17. не изменится; 18. 1,2 кг/м3; 19. 26,0 г; 20. 28 г, 4,65·10-23; 21. 47 г; 1,62; 22. 28 а.е.м.; 23. 58 г; 24. 820 мл; 25. 125000 Па; 26. 1 кг; 27. 0,214 кг. 28. в 1,03 раз; 29. 9,01; 30. 127; 31. 10 л; 32. 12,14; 33. 56,2; 34. ЭBr2 = 79,911, ЭМе = 9; 35. 32,69; 36. 1,76 г; 37. Эок = 24, ЭМе = 16; 38. ЭМе = 56,2, UH2 = 3,36 л; 39. 54,2; 40. 15 г и 24,9 г; 41. 2,8 л; 42. 3; 6; 12; 43. 28; 44. Al.
Глава 2.
12. Bi (z = 83); 15. Сu (z = 29); 16. Две, одна р – орбиталь занята наполовину (1 электрон); 17. Свободных d – орбиталей нет: три из пяти орбиталей заняты полностью, две – содержат по одному электрону, конфигурация подуровня 3 d8; 22. На внешнем слое могут быть только S и р – электроны, максимальное число их равно 8 в конфигурации ns2, np6, где n – номер внешнего слоя, его главное квантовое число; 28. а) CrO3, б) Mn2O7; 43. FeO – основной, Fe2O3 – отчасти амфотерный, FeO3 – кислотный; железная кислота H2FeO4, феррат калия K2FeO4. Окислительное число железа в этих соединениях +6; 29. Наиболее прочен NH3 и наименее BiH3; 32. 414,22 кДж/моль; 32. уменьшится; 33. 430,95 кДж/связь; 34. ЕС-С = 551,20 кДж/связь, ЕС≡С = 769,02 кДж/связь; 42. 277,2 кДж/моль; 43. 151,0 кДж/моль; 61. 7·10-8 моль/л; 63. 123,4 кДж/моль; 64. 86,5 кДж/моль.
Глава 3.
1. 0, +1, +2, +3, +4, +4, +5, -3; 2. +1, -2, +2, -1, 0, -3, +1, +5, -2, +1, -1, +1, +6, -2, +1, +6, -2, +1, +2, (-1); 3. а) только окислительные, и окислительные, и восстановительные, только восстановительные; б) окислительные, восстановительные, и окислительные, и восстановительные, восстановительные; 4. 1) восстановление, 2) восстановление, 3) окисление, 4) окисление; 5. а) невозможна, б) невозможна, в) невозможна, г) невозможна; 11. а) 158/2, б) 158 г, в) 158/3;
12. 
13. 
14. 1) нормальность 0,1м раствора KNO2 = 0,1; 2) нормальность 0,1м раствора KNO2 = 0,2; 15.  Самым лучшем окислителем будет FeCl3; 16.
Самым лучшем окислителем будет FeCl3; 16. 
 17.
17. 
 1) не возможна, 2) возможна, 3) возможна; 18.
1) не возможна, 2) возможна, 3) возможна; 18.
 1) нет, 2) нет, 3) да; 19. а) прямая, б) обратная; 20.
1) нет, 2) нет, 3) да; 19. а) прямая, б) обратная; 20.  а
а
 21. Нельзя, так как
21. Нельзя, так как 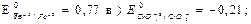 22. В прямом; 23. а) Да, б) Нет; 24. а) Да, б) Нет, в) Да.
22. В прямом; 23. а) Да, б) Нет; 24. а) Да, б) Нет, в) Да.
Глава 4.
2. а) в 2 раза, б) в 4 раза; 3. в 2 раза; 4. в 3 раза; 5. 0,1 л моль-1 мин-1; 6. Возрастает в 2 раза; 7. 4,17; 0,06 моль/л; 0,07 моль/л; 8. 2,1·10-2; 9. 0,415; 10. 5,5·10-3; 11. [CO] = 0,04 моль/л; [CO2] = 0,02 моль/л; 12. [H2] = 0,7 моль/л, [J2] = 0,5 моль/л; 13. 0,16; 14. 50 %, 83,3%, 90,9%; 15. 5,4; 0,08439; 16. V0 = 0,03; V1 = 0,0072; 17. возрастает в 27 раз, уменьшается в 4раза; 18. увеличится в 8 раз, уменьшится в 4 раза; 19. 18,64 м, 135,9 мин; 20. 3 мин 29 сек; 10 мин; 5,9 сек; 21. 3 часа 48 мин; 22. 7,9% 23. 0,02553; 24. примерно 40 мин; 25. 47,41 мин; 26. 0,0215 мин-1; 28. 10-5 моль/л, 30. в 100 раз;
32. 0,0874 мин-1; 33. 0,01557 мин-1; 34. 5,45·10-5; 35. 0,00145 мин-1; 36. 0,0328 л моль-1 с-1; 37. 21,35%; 38. 357 сек; 39. 0,0222 мин-1; 40. 0,0172 мин-1; 41. V2/V1 = 4,77; 42. 2,5; 43. в 105 раз; 44. на 370С; 45. 2,58; 46. 5,1 раза; 47. 1531,4 кДж/моль; 48. 127,6 кДж/моль; 49. 247,9 кДж/моль; 50. 49,9 кДж/моль; 51. 80,3 кДж/моль; 52. примерно 40 кДж/моль; 53. 32,983 кДж/моль; 30,950 кДж/моль; 54. 68,3; 55. 1,83; 40,66 кДж/моль; 56. 43,10С; 57. 189,8 кДж/моль; 58. 104,8 кДж/моль; 59. 189000 дж – моль; 0,1017; 60. 172,3 кДж/моль; 61. 41473 Дж/моль; 61. 67600 Дж/моль.
Не нашли, что искали? Воспользуйтесь поиском: