
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Теоретические основы метода
Комплексонометрия (комплексонометрическое титрование) – метод, основанный на реакциях образования комплексных соединений ионов металлов с этилендиаминтетрауксусной кислотой (ЭДТА) и другими аминополикарбоновыми кислотами – комплексонами. Комплексоны образуют с ионами металлов прочные комплексы состава 1:1 (комплексонаты), что исключает ступенчатое комплексообразование и упрощает анализ и расчеты. Большинство ионов металлов взаимодействуют с комплексонами практически мгновенно с образованием растворимых в воде малодиссоциированных соединений постоянного состава. Таким образом, метод обладает высокой чувствительностью, точностью, быстр и прост в исполнении и имеет достаточно высокую селективность.
К простейшим комплексонам относят производные аминокарбоновых кислот:
- комплексон I – нитрилотриуксусная кислота N(CH2COOH)3;
- комплексон II – этилендиаминтетрауксусная кислота (ЭДТУК, H4Y) – белый мелкокристаллический порошок, малорастворим в воде, нерастворим в большинстве органических растворителей, растворим в щелочах;
- комплексон III – динатриевая соль этилендиаминтетрауксусной кислоты (ЭДТА, трилон Б) – белый кристаллический порошок, растворимый в воде и щелочах. Образует очень устойчивые комплексные соединения с большинством катионов. Одна молекула комплексона III реагирует только с одним ионом металла (независимо от степени окисления), т.к. два иона трилона Б замещаются на металл любой степени окисления. Раствор трилона Б устойчив при хранении.
Точку эквивалентности определяют с помощью индикаторов. Применяют свежеприготовленные растворы или сухие индикаторные смеси, т.к. они не устойчивы. Чаще всего в комплексонометрии используют следующие индикаторы: эриохром черный Т или хромоген, мурексид.
В фармации комплексонометрическое титрование используют для количественного определения препаратов кальция (хлорид, глюконат, лактат), цинка (оксид и сульфат, цинк-инсулин), железа (лактат, сахарат, глицерофосфат), для определения жесткости воды.
Тема лабораторной работы: «Определение массы магния в растворе. Определение общей жесткости воды.».
Приготовление стандартных растворов комплекснометрического титрования
Работа 1. Установка титра и концентрации раствора трилона Б по стандартному раствору сульфата магния (сульфата цинка)
А. Приготовление стандартного раствора трилона Б.
Стандартный раствор готовят из приблизительной навески М(Nа2С10Н14О8N2. 2Н2О) = 372,25 г/моль.
1. Приготовьте 200 мл раствора ЭДТА с концентрацией 0,05 н.
2. Рассчитайте массу навески трилона Б по формуле:

3. Массу навески взвесьте на технохимических весах.
4. Объем воды отмерьте мерным цилиндром.
5. Растворите в конической колбе.
Б. Приготовление аммиачного буферного раствора.
1. В мерную колбу вместимостью 1 л внести 67,5 г NH4Cl .
2. Добавить 200 мл дистиллированной воды и тщательно перемешать до полного растворения.
3. Добавить 570 мл концентрированного раствора NH4OH. Довести объем раствора до метки дистиллированной водой. Перемешать. Полученный раствор будет иметь рН = 10.
В. Приготовление сухой индикаторной смеси.
В ступке тщательно растирают до состояния пудры 0,5 г эриохрома черного и 50 г KCl или NaCl. Для одного титрования берут 20 мг сухой смеси (на кончике шпателя).
Г. Приготовление стандартного раствора сульфата цинка.
Приготовление стандартного раствора МgSO4 (или ZnSO4) Рассчитывают массу МgSO4·7Н2О для приготовления 100 мл раствора с молярной концентрацией эквивалента 0,05 моль/л:
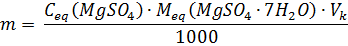
где VК – объем мерной колбы, мл.
Рассчитанное количество соли взвешивают на аналитических весах, переносят в мерную колбу, растворяют в воде и доводят объем раствора до метки. Раствор тщательно перемешивают. Если навеска отличается от расчетной навески, то производят перерасчет по формулам:


Д. Определение концентрации рабочего раствора трилона Б.
Проведение титрования.
1. Отбирите аликвотную часть раствора МgSO4 в колбу для титрования.
2. Добавте 5 мл аммиачной буферной смеси мерным цилиндром.
3. В раствор добавьте 3-4 кристалла индикатора эриохрома черного Т.
4. Бюретку заполните раствором ЭДТА.
5. Смесь оттитруйте (3 раза) трилоном Б до тех пор, пока винно-красная окраска не перейдет в ярко-голубую.
6. По показаниям бюретки определите объем раствора трилона Б, пошедшего на титрование, и полученные результаты заносят в таблицу:
| № пробы | V(ZnSO4), мл | V(H2Y2), мл | 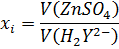
| 
|
| 1. 2. 3. … | ||||

| 
|
7. Вычислите относительную погрешность по формуле:
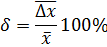
Относительная погрешность должна составлять не более 0,3%.
8. Рассчитайте концентрацию рабочего раствора ЭДТА и титр по определяемому веществу (например, по кальцию) по формуле:


Работа 2. Определение содержания магния в водном растворе.
Определение основано на взаимодействии ионов магния, находящихся в анализируемом растворе, с трилоном Б в присутствии аммонийной буферной смеси по уравнению реакции:
Mg2+ + H2Y2- = MgY2- + 2H+
Для определения конечной точки титрования применяют металлохромный индикатор – эриохром черный Т.
Ход работы.
1. Получите у преподавателя мерную колбу на 100 мл с контрольным раствором и доведите до метки дистиллированной водой. Контрольный раствор содержит ионы Mg2+. Тщательно перемешайте.
2. В коническую колбу для титрования внесите аликвоту (1/10 часть анализируемого раствора)
3. Добавьте 10 мл аммонийного буфера и сухую индикаторную смесь на кончике шпателя до фиолетовой окраски.
4. Бюретку заполните раствором трилона Б и титруйте до перехода окраски в синюю (без примеси фиолетового).
5. По показаниям бюретки определите объём раствора трилона Б, пошедшего на титрование, и полученные результаты заносят в таблицу:
| № пробы | Vi (H2Y2-), мл | 
|
| 1. 2. 3. … | ||

| 
|
6. Вычислите относительную погрешность по формуле:
 ,
,
Относительная погрешность должна составлять не более 0,3%.
7. Рассчитайте массу магния в анализируемом растворе с учетом аликвотной части по формулам:


Работа 3. Определение жесткости воды.
Общая жесткость воды обусловлена присутствием в ней солей кальция и выражается суммарным числом миллимоль эквивалентов (ммоль-экв) ионов магния и кальция в 1 л воды. Определение основано на взаимодействии ионов Ca2+ и Mg2+, находящихся в анализируемом растворе, с трилоном Б в присутствии аммонийного буфера с индикатором эриохром черный Т.
Ход работы.
1. Отбирают пипеткой 10 мл анализируемого раствора и переносят в коническую колбу вместимостью 100 – 250 мл.
2. Прибавляют 2 – 3 мл аммонийного буферного раствора с рН 10 и 15 мл воды.
3. Прибавляют к раствору на кончике шпателя сухую индикаторную смесь (см. работу 1). Раствор перемешивают до полного растворения индикаторной смеси.
4. Бюретку заполняют раствором трилона Б с концентрацией 0,05 н. и титруют до изменения окраски раствора из винно-красной в голубую. Процесс титрования повторите 3 раза.
5. Измерив объем трилона Б, пошедший на титрование данной порции воды, результат титрования заносят в таблицу:
| № пробы | Vi (H2Y2-), мл | 
|
| 1. 2. 3. … | ||

| 
|
6. Если результаты титрования совпадают (∆V ≤ 0,1 мл), то рассчитайте общую жесткость воды. В противном случае оттитруйте еще одну пробу воды. Найдите среднее значение объема раствора трилона Б и по закону эквивалентов рассчитайте общую жесткость воды (ммоль/л):

| <== предыдущая лекция | | | следующая лекция ==> |
| СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ. 1. Агапова Н.В. Перспективы развития новых технологий обучения | | | ПОРЯДОК ПОДГОТОВКИ К ЗАЩИТЕ ВЫПУСКНОЙ КВАЛИФИКАЦИОННОЙ РАБОТЫ |
Не нашли, что искали? Воспользуйтесь поиском: