
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
ЭЛЕКТРОХИМИЧЕСКИЕ МЕТОДЫ В ЛАБОРАТОРНЫХ АНАЛИЗАХ
3.1 ЛАБОРАТОРНЫЕ ПРИБОРЫ ДЛЯ ПОТЕНЦИОМЕТРИЧЕСКОГО АНАЛИЗА
Сущность метода
Метод потенциометрического измерения концентрации ионов в растворе основан на зависимости потенциала любого электрода от концентрации одноименных ионов в растворе. Например, потенциал водородного электрода зависит от концентрации ионов водорода, а потенциал металлического электрода – от концентрации ионов металла в растворе и т.д.
При погружении металлического электрода в раствор, содержащий ионы металла электрода, на межфазной границе электрод-раствор возникает скачок потенциала Е, определяемый уравнением Нернста
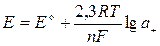 , (3.1)
, (3.1)
где Е о – стандартный потенциал, R – универсальная газовая постоянная,
F – число Фарадея (заряд грамм-эквивалентных ионов),
п – число электронов в реакции,
а + – активность (активная концентрация) ионов,
Таким образом, Е о – потенциал при а + = 1.
С повышением концентрации кислоты в растворе концентрация ионов Н + повышается. С ростом содержания щелочи в растворе растет концентрация ионов гидроксила (ОН-). Это приводит к уменьшению концентрации ионов водорода, при этом произведение концентраций [ H +]×[ OH- ] остается постоянной величиной.
По современному определению
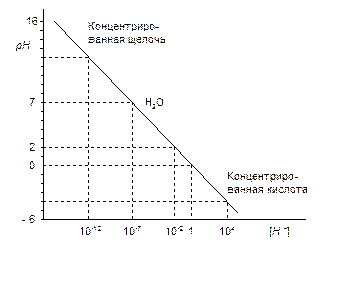
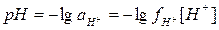 .
.
 |
Таким образом, рН представляет собой меру активности ионов водорода, равную отрицательному десятичному логарифму активности,
 – коэффициент активности (всегда меньше 1). Для чистой воды при температуре 22о С рН = - lg 10-7 = 7. По мере уменьшения рН кислотность раствора повышается (рН < 7), по мере увеличения рН повышается щелочность раствора (рН > 7). График рН приведен на рис. 3.1. Измерительным элементом потенциометрических приборов являются кювета с раствором и пара электродов – индикаторный и вспомогательный. В отличие от индикаторного электрода потенциал вспомогательного должен оставаться неизменным при колебаниях активности контролируемых ионов. Чтобы исключить изменения постоянства потенциала электрода за счет реакций с контролируемой средой электрод изолируют от среды. Вспомогательные электроды бывают каломельные и хлорсеребряные. В каломельных электродах
– коэффициент активности (всегда меньше 1). Для чистой воды при температуре 22о С рН = - lg 10-7 = 7. По мере уменьшения рН кислотность раствора повышается (рН < 7), по мере увеличения рН повышается щелочность раствора (рН > 7). График рН приведен на рис. 3.1. Измерительным элементом потенциометрических приборов являются кювета с раствором и пара электродов – индикаторный и вспомогательный. В отличие от индикаторного электрода потенциал вспомогательного должен оставаться неизменным при колебаниях активности контролируемых ионов. Чтобы исключить изменения постоянства потенциала электрода за счет реакций с контролируемой средой электрод изолируют от среды. Вспомогательные электроды бывают каломельные и хлорсеребряные. В каломельных электродах 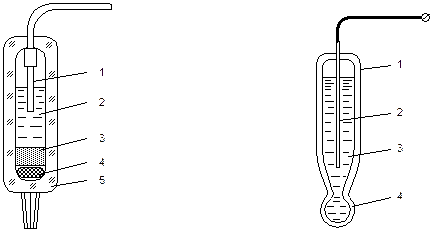 |
используется каломельная паста Hg2Cl2. Конструкция хлорсеребряного электрода
 |
показана на рис. 3.2. Он состоит из серебряного электрода 1, электролита 2, слоя AgCl 3, резиновой мембраны 4. Все это заключено в стеклянный корпус 5.
Потенциал индикаторного электрода зависит от активности контролируемых ионов. В качестве индикаторных электродов применяют водородные электроды, хингидронные, металлоксидные и стеклянные. Наиболее универсальным является стеклянный электрод (рис. 3.3). Он состоит из стеклянного корпуса 1, в котором помещен металлический электрод 2 и залит электролит 3. На конце корпуса имеется шарик-мембрана из электродного стекла, легированного натрием или литием 4. При погружении стеклянного электрода в раствор ионы натрия (или лития) вытесняются из стекла ионами водорода, и электрод приобретает свойства водородного электрода. ЭДС электродной системы, равная разности потенциалов электродов, согласно уравнению (3.1) зависит от рН и температуры. На рис. 3.4 представлено семейство характеристик Е эс(рН) при различных температурах раствора (t3 > t2 > t1). Е И, рН И – координаты изопотенциальной точки.
Не нашли, что искали? Воспользуйтесь поиском: