
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
ТЕМА 10. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ
РЕАКЦИИ
Вариант № 1
Дополните:
1. Окислительно-восстановительные реакции – это ______________________
2. Если алгебраическая величина степени окисления увеличивается, то протекает процесс _______, а с электронной точки зрения ________________
3. Окислитель в ходе реакции _______________, поэтому его алгебраическая величина степени окисления _________________________________________
4. Неметаллы (простые вещества) проявляют свойства _____, а с электронной точки зрения _______________________________________________________
5. Чем меньше алгебраическая величина стандартного окислительно-восстановительного потенциала (φоВ), тем сильнее выражены свойства _____
6. ЭДС = __, если ЭДС < 0, то окислительно-восстановительная реакция ____
7. В кислой среде: а) избыток кислорода в частице связываем ___________ с образованием _____________________________________________________
б) недостаток кислорода в частице берём из ________ с образованием _____________________________________________________
8. Для реакции K2Cr2O7 + KCl + H2SO4 → K2SO4 + Cr2(SO4)3 + Cl2 + H2O, если

 /
/  = + 1,36В,
= + 1,36В, 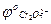 /
/  = 1,33В; ЭДС = ____, следовательно ____
= 1,33В; ЭДС = ____, следовательно ____
коэффициент перед восстановителем __________________________________
9. Установите соответствие:
| Окислительно-восстановительная реакция | Тип реакции |
| А. 3H2S + 2HNO3 → 3S + 2NO + 4H2O | 1. Диспропорционирования |
| Б. 5NaI + NaIO3 + 3H2SO4 → 3I2 + 3Na2SO4 +3H2O | 2. Внутримолекулярная |
| В. Cl2 + 2KOH → KCl + KClO + H2O | 3. Межмолекулярная |
| Г. 2KClO3 → 3O2 + 2KCl | 4. Сопропорционирования |
Выберите правильный вариант ответа:
10. Только восстановительные свойства проявляют вещества
1) KIO3 2) KIO2 3) KI 4) I2
11. Окислительно-восстановительную двойственность проявляют (два варианта ответа) ___________________________
1) N2 2) NH3 3) NaNO2 4) NaNO3
12. В уравнении реакции Сu + HNO3 (разб.) → ______________ коэффициент
перед окислителем _____________________________
1) 8 2) 10 3) 6 4) 4
13. В уравнении реакции, схема которой
Cu2S + HNO3 → Cu(NO3)2 + H2SO4 + NO + H2O,
сумма коэффициентов
1) 45 2) 50 3) 60 4) 52
Дайте полное решение задания, используя ионно-электронный метод.
Вариант № 2
Дополните:
1. Cтепень окисления – это ___________________________________________
2. Частица (атом, ион или молекула), отдающая электроны называется ______
3. Окислительно-восстановительные реакции называют сопряженными, так как __
4. Самые активные восстановители – это _______________________________
5. ЭДС рассчитывают по формуле _____________________________________
6. Сложные вещества, содержащие элемент в низкой степени окисления, играют роль _______________________________________________________
7. В щелочной среде: а) недостаток кислорода в частице берём из _____ с образованием _____________________________________________________
б) избыток кислорода в частице связываем _______ с образованием ______________________________________________________
8. Для реакции K2Cr2O7 + KBr + H2SO4 → K2SO4 + Cr2(SO4)3 + Br2 + H2O, если
 /
/  = + 1,06В,
= + 1,06В, 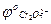 /
/  = 1,33В; ЭДС = ___, следовательно ____
= 1,33В; ЭДС = ___, следовательно ____
коэффициент перед восстановителем _________________________________
9. Установите соответствие:
| Окислительно-восстановительная реакция | Тип реакции |
А. 2Cu(NO3)2 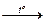 O2 + 4NO2 + 2CuO O2 + 4NO2 + 2CuO
| 1. Межмолекулярная |
| Б. 2NO + H2O → HNO3 + HNO2 | 2. Диспропорционирования |
| В. 4NH3 + 5O2 → 4NO + 6H2O | 3. Внутримолекулярная |
| Г. 2Na2S + Na2SO3 + 3H2SO4 → 3S + 3Na2SO4+3H2O | 4. Сопропорционирования |
Выберите правильный вариант ответа:
10. Только окислительные свойства проявляет вещество
1) KClO4 2) KCl 3) KClO3 4) Cl2
11. Окислительно-восстановительную двойственность проявляют (два варианта ответа)
1) H2SO4 2) Na2SO3 3) H2S 4) S
12. В уравнении реакции Zn + HNO3 (сильно разб.) → _______ коэффициент
перед окислителем ___________________
1) 10 2) 8 3) 6 4) 4
13. В уравнении реакции, схема которой
Fe(OH)3 +Br2 +KOH→ K2FeO4 +KBr +H2O
сумма коэффициентов
1) 31 2) 40 3) 45 4) 47
Дайте полное решение задания, используя ионно-электронный метод
Вариант № 3
Дополните:
1. Cущностью окислительно-восстановительных реакций является _________
2. Если алгебраическая величина степени окисления уменьшается, то протекает процесс ______________, а с электронной точки зрения _________
3. Металлы (простые вещества) проявляют только свойства __________, а с электронной точки зрения __________________________________________
4. Сложные вещества, содержащие элемент в высшей степени окисления играют роль _______________________________________________________
5. Количественной характеристикой окислительно-восстановительной способности веществ является величина, называемая _______, обозначается буквой __
6. Если ЭДС > 0, то окислительно-восстановительная реакция _____________
7. В нейтральной среде а) избыток кислорода в частице связываем ______ с образованием _____________________________________________________
б) недостаток кислорода в частице берём из _________ с образованием _________________________________
8. Для реакции K2Cr2O7 + KI + H2SO4 → K2SO4 + Cr2(SO4)3 + I2 + H2O, если

 /
/  = 0,54В,
= 0,54В, 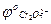 /
/  = 1,33В; ЭДС = ___, следовательно _______
= 1,33В; ЭДС = ___, следовательно _______
коэффициент перед восстановителем __________________________________
9. Установите соответствие:
| Окислительно-восстановительная реакция | Тип реакции |
А. 2KNO3 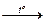 O2 + 2KNO2 O2 + 2KNO2
| 1. Межмолекулярная |
| Б. 2H2S + H2SO3 → 3S + 3H2O | 2. Внутримолекулярная |
| В. Cl2 + 2NaOH → NaCl + NaClO + H2O | 3. Сопропорционирования |
| Г. 2ZnS+ 3O2 → 2ZnO + 2SO2 | 4.Диспропорционирования |
Выберите правильный вариант ответа:
10. Только восстановительные свойства проявляют вещества
1) KMnO4 2) MnO2 3) Mn 4) K2MnO4
11. Окислительно-восстановительную двойственность проявляют
1) KClO4 2) KCl 3) KClO2 4) Cl2
12. В уравнении реакции Mg + H2SO4 (конц.) → ____________ коэффициент
перед окислителем ____________________
1) 5 2) 4 3) 8 4) 4
13. В уравнении реакции, схема которой
H2S + K2Cr2O7 + Н2SO4 → S + Cr2(SO4)3 + K2SO4 + H2O
сумма коэффициентов
1) 20 2) 25 3) 30 4) 15
Дайте полное решение задания, используя ионно-электронный метод.
Вариант № 4
Дополните:
1. Окисление – это процесс __________________________________________
2. Частица (атом, ион или молекула), принимающая электроны называется __
3. Восстановитель в ходе окислительно-восстановительной реакции _______, поэтому его алгебраическая величина степени окисления _________________
4. Самые активные окислители – это __________________________________
5. Чем больше величина стандартного окислительно-восстановительного потенциала (φоВ), тем сильнее выражены свойства ______________________
6. Если ЭДС = 0, то окислительно-восстановительная реакция _____________
7. В кислой среде а) недостаток кислорода в частице берём из _________ с образованием ______________________________________________________
б) избыток кислорода в частице связываем _________ с образованием ______________________________________________________
8. Для реакции K2Cr2O7 + KF + H2SO4 → F2 + K2SO4 + Cr2(SO4)3 + H2O,
если

 /
/  = 2,85В,
= 2,85В, 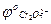 /
/  = 1,33В; ЭДС = _____, следовательно ____
= 1,33В; ЭДС = _____, следовательно ____
коэффициент перед восстановителем __________________________________
9. Установите соответствие:
| Окислительно-восстановительная реакция | Тип реакции |
| А. (NH4)2Cr2O7 → N2 + Cr2O3 + 4H2O | 1. Диспропорционирования |
| Б. CuSO4 + Fe → FeSO4 + Cu | 2. Межмолекулярная |
| В. Cl2 + H2O → HCl + HClO | 3. Внутримолекулярная |
| Г. 5KI+ KIO3 + 3H2SO4 → 3I2 + 3K2SO4 + 3H2O | 4. Сопропорционирования |
Выберите правильный вариант ответа:
10. Только восстановительные свойства проявляют вещества
1) NH3 2) N2 3) NaNO3 4) NaNO2
11. Окислительно-восстановительную двойственность проявляют
1) K2CrO7 2) KCrO2 3) Cr 4) Cr2O3
12. В уравнении реакции Ag + HNO3 (разб.) → _____________ коэффициент
перед окислителем _________________________________
1) 4 2) 5 3) 8 4) 6
13. В уравнении реакции, схема которой
Na2S + KMnO4 + H2SO4 → Na2SO4 + MnSO4+ K2SO4 + H2O
сумма коэффициентов перед формулами исходных веществ
1) 25 2) 29 3) 15 4) 16
Дайте полное решение задания, используя ионно-электронный метод.
Не нашли, что искали? Воспользуйтесь поиском: