
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Позначення констант рівноваг
| Реакції (загальний вигляд та приклади) | Позначення | Примітки |
| 1. Константи стійкості комплексів | ||
| m M + n L D M m L n | b nm | Загальні константи стійкості |
| 2 Ag+ + 6 I‑ D Ag2I64‑ | b62 | |
| M + n L D ML n | b n | Для одноядерних комплексів m = 1 опускають |
| Ag+ + NH3 D AgNH3+ | b1 | |
| Ag+ + 2 NH3 D Ag(NH3)2+ | b2 | |
| ML n ‑1 + L D ML n | Kn | K – ступінчаті константи стійкості, Kn = b n / b n ‑1 |
| Ag+ + NH3 D AgNH3+ | K 1 | |
| AgNH3+ + NH3 D Ag(NH3)2+ | K 2 | |
2O D H+ + OH‑ 
| Kw | Іонний добуток води |
| m H+ + L D H m L | bH m | Якщо L – ліґанд, H+ комплексоутворювач, то bH m – це b1 m |
| H+ + PO43‑ D HPO42‑ | bH1 | |
| 2 H+ + PO43‑ D H2PO4‑ | bH2 | |
| 3 H+ + PO43‑ D H3PO4 | bH3 | |
| H+ + H m ‑1L D H m L | K H m | K H m – ступінчаті константи стійкості K H m = bH m / bH(m ‑1) |
| H+ + PO43‑ D HPO42‑ | K H1 | |
| H+ + HPO42‑ D H2PO4‑ | K H2 | |
| H+ + H2PO4‑ D H3PO4 | K H3 | |
| H m +1L D H m L + H+ | Ka (N ‑ m) | Ступінчата константа іонізації кислоти H N L, Ka (N‑m) = 1 / K H(m +1) |
| H3PO4 D H+ + H2PO4‑ | Ka 1 | |
| H2PO4‑ D H+ + HPO42‑ | Ka 2 | |
| HPO42‑ D H+ + PO43‑ | Ka 3 | |
| m M + n OH‑ D M m (OH) n | b nm | Константи стійкості гідроксокомплексів (окремого випадку комплексів) |
| 2 Fe3+ + 2 OH‑ D Fe2(OH)24+ | b22 | |
| Hg2+ + OH‑ D HgOH+ | b1 | |
| Hg2+ + 2 OH‑ D Hg(OH)2 | b2 | |
| Hg2+ + 3 OH‑ D Hg(OH)3‑ | b3 |
2. Константи кислотно-основних рівноваг (продовження)
| m M + n H2O D M m (OH) n + n H+ | *b nm | Константа взаємодії іона металу з H2O *b nm = b nm K wn, m = 1 опускають |
| 2 Fe3+ + 2 H2O D Fe2(OH)24+ + 2 H+ | *b22 | |
| M + n H2O D M(OH) n + n H+ | *b n | |
| Hg2+ + H2O D HgOH+ + H+ | *b1 | |
| Hg2+ + 2 H2O D Hg(OH)2 + 2 H+ | *b2 | |
| Hg2+ + 3 H2O D Hg(OH)3‑ + 3 H+ | *b3 | |
| 3. Константи гетероґенних реакцій | ||
L D L(орг), або L D  , ,
| K D | Константа розподілу (в дужках – розчинник) |
Br2 D Br2(CCl4), або Br2 D 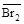
| ||
| Al3+ + 3 HOxin (орг) D D AlOxin3 (орг)+ 3 H+ | K ex | Загальна константа екстракції |
| L(g) D L | Kp | Закон Генрі, p в атмосферах |
| CO2(g) D CO2 | ||
| L(s) D L, L(l) D L, | Ks | Розчинність (s – тверда, l – рідка речовина) |
| I2(s) D I2, Br2(l) D Br2, | ||
| M m L n (s) D m ML q + (n – m q) L | Ksq | Добуток розчинності (q = 0 можна опускати), Ksq = Ks 0 b q. Нижче – складний випадок, де слідом за Ks у дужках наведено продукти у розчині. |
| HgI2(s) D Hg2+ + 2 I‑ | Ks 0 | |
| HgI2(s) D HgI+ + I‑ | Ks 1 | |
| HgI2(s) D HgI2 | Ks 2 | |
| HgI2(s) + I‑ D HgI3‑ | Ks 3 | |
| HgI2(s) + 2 I‑ D HgI42‑ | Ks 4 |
Концентраційні константи. Константу рівноваги, виражену через рівноважні концентрації (3) називають концентраційною. Підставляючи вираз (6) у ЗДМ (3), приходимо до його аналоґа із рівноважними концентраціями замість активностей,

Або дотримуючись алгебраїчного підходу в записі реакцій і рівнянь, маємо:
 = K c = K · (
= K c = K · ( )-1,
)-1,
lg K c = lg K -  lg (
lg ( ) = lg K –
) = lg K –  a j lg g j. (15)
a j lg g j. (15)
Концентраційна константа рівноваги K c залежить від складу розчину через g j. Часто користуючись K c, не вказуватимемо індекс «c». У довідниках наводять як термодинамічні (при І = 0), так і концентраційні константи.
Приблизно оцінюючи іонну силу, обмежуємось внеском від переважаючих компонентів, зокрема іонів сильних електролітів (тих, що дисоційовані повністю). Досліджуючи константи, з сильних електролітів утворюють так званий «сольовий фон», що стабілізує коефіцієнти активності. У водяних розчинах сильними є кислоти HCl, HClO4, HBr, HI, H2SO4 (за першим ступенем дисоціації), HNO3; основи та солі з катіонами Na+, K+, Rb+, Cs+ , не схильними до комплексоутворення, і солі з аніоном ClO4‑.
Рівноважні концентрації розраховують за концентраційними константами, вдаючись до ітерацій (послідовних наближень). Розрахувавши [A j ] за lg K c, що відповідають наближеній іонній силі, уточнюють І та lg K c, й знову [A j ]. Процес закінчують, якщо значення lg K c відрізняються від попередніх у межах похибок. Ітерації сходяться, бо lg K c повільно змінюються з [A j ].
Наприклад, для реакції
Ca5(OH)(PO4)3(s) D 5 Ca2+ + OH- + 3 PO43-, lg Ks = ‑55,91 [ I =0],
lg Ks c у середовищі c (NaClO4) = 0,1 моль/л обчислюємо так. Електроліт NaClO4 – сильний,
[Na+] = [ClO4‑] = c (NaClO4) = 0,1 моль/л.
Без внеску від продуктів реакції іонна сила
I = {[Na+] + [ClO4‑]} / 2 = 0,1.
За формулою Девіса,
lg g = ‑ 0,5  / (1 +
/ (1 +  ) + 0,15 I = -0,105.
) + 0,15 I = -0,105.
Підставляючи її у вираз (6), маємо
lg Ks с = lg Ks ‑ {  a j zj 2} lg g = ‑55,91 ‑ {5·22 +
a j zj 2} lg g = ‑55,91 ‑ {5·22 +
+ 1·(‑1)2 + 3·(‑3)2}·(-0,105) = ‑55,91 + 30·0,105 = -52,76.
Не нашли, что искали? Воспользуйтесь поиском: