
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Проби на присутність аніонів‑відновників.
а) До 3-4 крапель розчину додайте 1-2 краплі розчину з c (H2SO4) = 1 моль/л, 1-2 краплі розчину I2 у KI та 6-8 крапель розчину крохмалю. Якщо розчин знебарвлюється, то можлива присутність ioнiв SО32‑ чи S2О32‑.
б) До 3-4 крапель розчину, що підкислений рівним об’ємом розчину з с (Н2SО4) = 1 моль/л, додайте 1-2 краплі розчину КМnО4 Якщо КМnО4 знебарвлюється, то можлива присутність ioнів SО32‑ S2О32‑, І‑ та Вг‑. Останні, окиснюючись, переходять відповідно у І2 та Br2, i з’являється відповідне забарвлення.
11.1.4. Проби на присутність аніонів‑окисників. Для проб використовуйте декілька крапель розчину.
(а) Додайте розчин НСl до кислої реакції, 3‑4 краплі ССl4, 1‑2 краплі розчину КІ. Шар ССl4 забарвлюється вільним іодом, якщо присутні CrO42‑, NO2‑, IO3‑, ClO3‑ або AsO43‑.
(б) Додайте 10‑15 крапель розчину MnCl2 у НСl із с = 12 моль/л. Суміш нагрійте на киплячій водяній бані. Утворення темно-бурого MnCl52‑ свідчить про присутність CrO42‑, NO2‑, IO3‑, ClO3‑.
11.2. Реакції іона борату В(ОН)4‑.
11.2.1. Відношення до групових реагентів. У 4 пробірки додайте по декілька крапель розчину Na2B4O7 та додайте у них розчини відповідно CaAc2, BaAc2, CdAc2 та AgAc. Відзначте кількість й колір осадів та випробуйте їх розчинність у розчинах із Na2B4O7 = 3 моль/л та c (HAс) = 3 моль/л.
11.2.2. Декілька крапель розчину Na2B4O7 випарте у чашці насухо, змочіть краплею концентрованої Н2SО4, додайте СН3ОН й підпаліть. Утворюється борно-метиловий ефір, що забарвлює край полум’я у зелений колір.
11.3. Реакції іона карбонату, СО32‑.
11.3.1. Розклад карбонатів у діоксид карбону (діоксид вуглецю). Підкислюючи розчин карбонату, вилучаємо леткий СО2(g), що утворює каламуть із вапняною водою (насиченим розчином Са(ОН)2),
СО32‑ + 2 Н+ D СО2(g) + Н2О,
СО2(g) + Са(ОН)2 D СаСО3(s) + Н2О.
Із великим надлишком СО2(g) каламуть поступово щезає, бо утворюється розчинний гідрокарбонат
СаСО3(s) + СО2(g) D Са2+ + 2 НСО3‑.
Підкислюючи розчин із SО32‑ чи S2О32‑, утворюємо SO2(g), від якого вапняна води також мутніє. Тому ці іони попередньо окиснюють у лужному середовищі до SO42‑, або перед підкисленням уводять розчин Н2O2 (масова частка 3 %).
У пробірку з газовідвідною трубкою вмістіть декілька крапель розчину Nа2СОз та рівний об'єм розчину з с (НС1) = 3 моль/л. Пробiрку закрийте пробкою з газовідвідною трубкою, кінець якої введено в іншу пробірку з вапняною водою. Опишіть Ваші спостереження?
11.4. Реакції іона ацетату, СН3СОO‑.
11.4.1. У пробірку вміщують 3-4 краплі розчину NaАс, додають рівний об’єм розчину з c (H2SO4) = 3 моль/л, перемішують, трохи підігрівають. Утворюється оцтова кислота з характерним запахом
Н+ + Ас‑ D НАс.
11.4.2. У пробірку вмістіть 3-4 краплі розчину NaАс, додайте 3‑4 краплі концентрованої H2SO4 й рівний об’єм етанолу, нагрійте на водяній бані 2‑3 хв. й швидко вилийте суміш у стакан із холодною дистильованою водою. Спостерігайте за виглядом та запахом компонентів сумiші.
Спирти (зокрема етанол) у середовищі H2SO4 утворюють з оцтовою кислотою складні ефіри (тут – етилацетат), малорозчинні у воді та з характерним запахом,
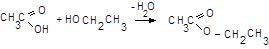
11.4.3. У пробірку вмістіть 2-3 краплі розчину NaАс, додайте рівний об’єм розчину FeCl3, розведіть у 2-3 рази дистильованою водою і нагрійте.
Хлорид феруму (ІІІ) утворює ацетатний комплекс феруму червоно-бурого кольору, що від слабкого нагрівання гідролізується з утворенням червоно-бурого осаду,
Fe3+ + 3 Ac‑ + 2 H2O D Fe(OH)2Ac(s) + 2 HAc.
11.5. Реакції іона тіоціанату, SСN‑.
11.5.1. Відношення до групових реагентів. У 4 пробірки вмістіть по декілька крапель розчину КSСN та додайте у них розчини відповідно CaAc2, BaAc2, CdAc2 та AgAc.
Випробуйте розчинність осаду AgSСN(s) у розчинах із c (НNO3) = 3 моль/л, c (NН3) = 3 моль/л та концентрованому розчині NaCl. Рідину, що одержана в останньому досліді, відокремте від осаду та додайте до неї краплю розведеного розчину FeCl3. Відзначте колір розчину.
Запишіть рівняння реакцій, розрахуйте їх константи рівноваги. За їх величинами поясніть, чому в останній реакції використовують саме концентрований розчин NaCl.
11.5.2. Реакція Fe3+ з тіоціанатом. Пригадайте дослід 6.1.3.
11.5.3. Руйнування іона SСN‑ прожарюванням. Вмістіть у чашку декілька кристаликів КSСN й ретельно прожарте. Охолодіть, розчиніть у воді й пробою з FeCl3 впевніться, що іон SСN‑ повністю відсутній.
11.6. Реакції іона силікату, SіО32‑.
11.6.1. Відношення до групових реагентів. У 4 пробірки додайте по декілька крапель розчину Na2SіО3 та додайте у них розчини відповідно CaAc2, BaAc2, CdAc2 та AgAc. Випробуйте розчинність осадів у розчинах із c (НNO3) = 3 моль/л та c (НАс) = 3 моль/л.
Запишіть рівняння реакцій та розрахуйте їх константи рівноваги.
11.6.2. Осадження гелю силіцієвої кислоти. Розведіть водою декілька крапель розчину Na2SіО3, додайте рівний об’єм розчину NН4Сl й нагрійте на киплячій водяній бані. Відзначте зовнішній вигляд осаду та випробуйте його розчинність у розчинах із c (НСl) = 3 моль/л та c (NаОН) = 3 моль/л.
Запишіть рівняння реакцій та розрахуйте їх константи рівноваги.
11.6.3. Реакція з молібдатом амонію та бензидином. На білу крапельну пластинку нанесіть по краплі розчинів Na2SіО3, льодяної оцтової кислоти та молібденової рідини, перемішайте. Додайте 1-2 краплі розчину бензидину й надлишок сухого NаАс. Знову перемішайте, відзначте зміну кольору. Щоб порівняти, якісно зробіть контрольний дослід – із тими ж реактивами, але без Na2SіО3.
Пояснюючи цей процес, майте на увазі, що: (а) силікат та молібдат утворюють у кислому середовищі силікомолібденову гетерополікислоту, H8{Si(Mo2O7)6}; (б) окисні властивості молібдену (VI) у цій сполуці вищі, ніж у вихідному молібдаті, й вона окиснює бензидин до синього продукту, як у досліді 4.3.3; (в) гетерополікислота відновлюється до синього продукту, що містить як молібден (VI), так і молібден (V), склад точно невідомий.
11.7. Реакції іона гексафторосилікату, SіF62‑.
11.7.1. Відношення до групових реагентів. Вмістіть у 4 пробірки по декілька крапель розчину Na2SіF6, додайте у них розчини відповідно CaAc2, BaAc2, CdAc2 та AgAc. Випробуйте розчинність осадів у розчині з c (НNO3) = 3 моль/л.
Запишіть рівняння реакцій і розрахуйте їх константи рівноваги.
11.7.2. Реакція з розчином амоніаку. Змішайте у пробірці розчини Na2SіF6 та NН3. Чи знайомий Вам зовнішній вигляд осаду? Запишіть рівняння реакції.
11.8. Реакції іона нітpиту, NO2‑.
11.8.1. Відношення до групових реагентів. Випробуйте, чи утворюються осади у сумішах розчину NaNО2 та розчинів відповідно CaAc2, BaAc2, CdAc2 та AgAc?
11.8.2. Окиснювальні властивості. У пробірку з 1 краплею розчину, с (NaNO2) = 2 моль/л, додайте по 1 краплі розчинів NaOH та KI. Чи помітна взаємодія у суміші? Додайте НСl до кислої реакції. Що спостерігається тепер?
Яка речовина спричинила зміну кольору (доведіть, додавши розчин крохмалю)? Запишіть рівняння реакцій.
11.8.3. Реакція Ґрісса. У пробірку із 1 краплею розчину с (NaNО2) = 2 моль/л, додайте 10 крапель дистильованої води. До 1 краплі розведеного розчину додайте 3-5 крапель розчину НАс та 10 крапель реактиву Ґрісса. Перемішайте, відзначте забарвлення розчину.
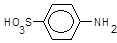
Реактив Ґрісса є розчином оцтової та сульфанілової кислот, остання icнує у розчині як цвітер-ioн (біполярний іон),
| D | 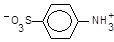
| , | |||
| та a-нафтиламіну, | 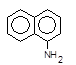
| У цій дуже чутливій реакції | ||||
сульфанілову кислоту діазотують, утворюючи діазоній-іон,
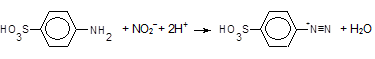 ,
,
який азосполучують із a-нафтиламіном,
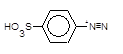 +
+ 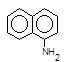 ®
® 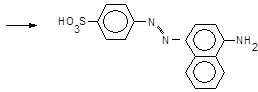 + H+
+ H+
Утворюється азобарвник рожевого кольору.
Зверніть увагу на власний колір Вашого реактиву Ґрісса! Свіжий розчин безбарвний, але при тривалому зберіганні з контактом із повітрям лабораторії він може стати рожевим під впливом оксиду нітрогену (азоту).
11.8.4. Відокремлення NО2‑, що заважає виявленню NО3‑, найзручніше здійснювати реактивом Мартинченко-Красовицького (о‑аміноанилідом дифенової кислоти), званого «нітритоном».
У цій реакції, як і у реакції Ґрісса, нітритна кислота діазотує реаґент. Продукт, відщеплюючи 2 протони (цьому сприяє лужне середовище), перетворюється у нерозчинну у воді білу триазольну сполуку.
| |||
| ® | 
| 
| |
Візьміть у пробірку 5 крапель розведеного (як у досліді 11.8.3) розчину NaNО2, підкисліть його краплею розчину з с (НСl) = 3 моль/л і додайте розчин реагенту у сірчаній кислоті до повного осадження. Додайте розчин NaОН до лужного середовища, відокремте осад центрифуґою й упевніться (за реакцією 11.8.3), що NО2‑ вилучено повністю.
11.9. Реакції іона нітрату, NO3‑.
11.9.1. Відношення до групових реагентів. Випробуйте, чи утворюються осади, змішуючи розчин NaNО3 та розчини відповідно CaAc2, BaAc2, CdAc2 та AgAc.
11.9.2. Буре кільце. У пробірку з 10 краплями розчину з с (NаNО3) = 2 моль/л додайте 2-3 кристалика FeSO4 та, струшуючи пробірку, повністю їх розчиніть. Потім, держачи пробірку похило, долийте по стінках 5-7 крапель концентрованої H2SO4 так, щоб вона не перемішувалась iз розчином у пpoбipцi. Кислота, як значно густіша, осідає на дно пробірки, i на поверхні розділу шарів утворюється кільце, забарвлене у бурий колір, властивий комплексові FeNO2+. Воно щезає, якщо розчин перемішати,
3 Fe2+ + 2 NO3– + 4 Н+ D Fe3+ + NO + 2 Н2О,
Fe2+ + NO D FeNO2+.
11.9.3. Відновлення до амоніаку. У пробірці до 5 крапель розчину з c (NaNO3) = 2 моль/л додайте рівний об’єм розчину з c (NaOH) = 3 моль/л й трохи алюмінієвої стружки або цинкового пилу. Нагрійте на водяній бані й піднеcіть до отвору пробірки вологий червоний лакмусовий папір. Спостерігайте за зміною його кольору на синій.
Метали Al(s) або Zn(s) у лужному середовищі відновлюють NO3‑,
3 NO3‑ + 8 Al(s) + 5 OH‑ + 8 Н2О D 3 NH3 + 8 Al(OH)4‑,
NO3‑ + 4 Zn(s) + 7 OH‑ + 6 Н2О D NH3 + 4 Zn(OH)42‑.
За запахом або за посинінням лакмусового паперу виявіть NH3. Природно, що вихідні реагенти не повинні містити солей амонію.
11.10. Реакції іона фосфату, PO43‑.
11.10.1. Відношення до групових реаґентів. У 4 пробірки вмістіть по декілька крапель розчину Na2SіF6 та додайте відповідно розчини CaAc2, BaAc2, CdAc2 та AgAc. Випробуйте розчинність осадів у розчинах із c (НNO3) = 3 моль/л та з c (НАс) = 3 моль/л.
Запишіть рівняння реакцій та розрахуйте їх константи рівноваги.
11.10.2. До 2-3 крапель розчину з с (МgСl2) = 1 моль/л у пробірці додайте рiвний об’єм розчину з c (NH3) = 3 моль/л. Якщо утворився аморфний Mg(OH)2(s), додайте декілька крапель розчину NН4Сl, щоб осад розчинився. Одержану «магнезійну суміш» нагрійте на водяній бані й додайте розчин Na2HPO4, поки не утвориться осад
Mg2+ + NH3 + НРО42‑ D MgNH4PO4(s).
11.10.3. У пробірку вмістіть 5-6 крапель молібденової рідини, нагрійте до» 40 °С та, перемішуючи, додайте 1-2 краплі розчину Na2HPO4. Випадає жовтий кристалічний осад
2 Н+ + НРО42‑ D Н3РО4, 2 H+ + МоO42‑ D Мо2O72‑ + H2О,
Н3РO4 + 3 NH4+ + 6 Мo2O72- + 9 H+ D (NH4)3H4P(Mo2O7)6(s).
Його утворення полегшує тертя внутрішніх стінок пробірки скляною паличкою. Осад здатний розчинятися у надлишку розчину Na2HPO4. Іони SО32‑ чи S2О32‑ відновлюють осад до «молібденової сині».
Випробуйте, чи утворюється відповідний осад, якщо до вихідної суміші додати надлишок (приблизно 0,2 г.) твердої солі винної кислоти, наприклад, сеґнетової солі, KNaC4H4O6.
11.11. Реакції іона арсеніту, As(OH)4‑.
11.11.1. Відношення до групових реагентів. У 4 пробірки вмістіть по декілька крапель розчину NaAs(OH)4 та додайте відповідно розчини CaAc2, BaAc2, CdAc2 та AgAc. Випробуйте розчинність осадів у розчині з c (НАс) = 3 моль/л.
Запишіть рівняння реакцій та розрахуйте їх константи рівноваги.
11.11.2. Утворення сульфіду арсену (ІІІ), As2S3(s).До 2-3 крапель розчину NaAs(OH)4 у пробірці додайте рiвний об’єм розчину Na2S, перемішайте. Осад не утворюється. Підкисліть розчином із с (НСl) = 3 моль/л. Відзначте колір осаду, що поступово утворюється.
Запишіть рівняння реакцій, зауваживши, що у лужному середовищі утворюються розчинні комплекси As (ІІІ) із S2‑ (й, можливо, із ОН‑).
11.10.3. Реакція з солями купруму (ІІ). У пробірку вмістіть 1 краплю розчину Cu(NO3)2, налийте доверху воду, перемішайте. Відберіть в іншу пробірку 3-4 краплі розведеного розчину, додайте 1 краплю розчину з с (NaOН) = 3 моль/л, 2 краплі розчину NaAs(OH)4, нагрійте протягом декількох хвилин на водяній бані. Випадає червоний осад Cu2O(s).
Запишіть рівняння реакцій, знайдіть відповідний lg K.
11.12. Реакції іона арсенату, AsO43‑.
11.12.1. Відношення до групових реагентів. У 4 пробірки внесіть по декілька крапель розчину Na3AsO4 та додайте у них розчини відповідно CaAc2, BaAc2, CdAc2 та AgAc. Випробуйте розчинність осадів у розчині з c (НАс) = 3 моль/л.
Запишіть рівняння реакцій та розрахуйте їх константи рівноваги.
11.12.2. Повторіть дослід 11.10.2 (для іона фосфату), замінивши розчин Na2HPO4 на Na3AsO4. Порівняйте результати.
11.12.3. Повторіть дослід 11.10.3 (для іона фосфату), замінивши розчин Na2HPO4 на Na3AsO4. Порівняйте результати. Чи випадає осад при наявності солі винної кислоти? Вплив останньої можна пояснити утворенням комплексів винної кислоти з арсеном (V).
11.13. Реакції іона сульфіду, S2‑.
11.13.1. Відношення до групових реагентів. У 4 пробірки вмістіть по декілька крапель розчину Na2S та додайте відповідно розчини CaAc2, BaAc2, CdAc2 та AgAc. Де утворюються осади й якого кольору? Подійте на осад CdS(s) розчином Cu(NO3)2. Поясніть зміну кольору осаду, підрахувавши константу рівноваги для реакції
CdS(s) + Cu2+ D CuS(s) + Cd2+.
11.13.2. Утворення газоподібного Н2S(g). До декількох крапель розчину Na2S додайте розчин із с (НСl) = 3 моль/л, струсіть, внесіть (не торкаючись стінок!) смужку фільтрувального паперу, змочену розчином Pb(NO3)2. Якщо потрібно, підігрійте. Спостерігайте за змінами кольору смужки.
Запишіть рівняння реакцій. Покажіть орієнтовним розрахунком, чи можна дією НСl здобути Н2S(g) із осадів FeS(s), ZnS(s), CuS(s), HgS(s).
11.14. Реакції іона сульфіту, SO32‑.
11.14.1. У пробірку з 2-3 краплями розчину Na2SO3 додайте рівний об’єм розчину SrCl2 або СаCl2
Sr2+ + SO32‑ D SrSO3(s), Са2+ + SO32‑ D СаSO3(s).
Додаючи розчин із с (HCl) = 3 моль/л, дослідіть розчинність осаду,
SrSO3(s) D Sr2+ + SO2(g) + Н2O, СаSO3(s) D Са2+ + SO2(g) + Н2O.
11.14.2. В одну пробірку вмістіть 1-2 краплі розчину КМnО4, додайте 3-4 краплі розчину з c (H2SO4) = 3 моль/л й по краплях розчин Na2SO3, аж поки суміш не знебарвиться. В іншу пробірку вмістіть 1-2 краплі розчину KІ3, 1 краплю розчину крохмалю й по краплях розчин Na2SO3, аж поки суміш не знебарвиться. Окисники реаґують із SO32‑,
2 H+ + SO32‑ D SO2 + H2O,
5 SO2 + 2 MnO4‑ + 2 H2O D 5 SO42‑ + 2 Mn2+ + 4 H+,
SO32‑ + I3‑ + H2O D SO42‑ + 2 H+ + 3 I‑.
Розрахуйте константи рівноваги наведених реакцій.
11.14.3. У пробірку до 3-4 крапель розчину Na2SO3 додайте 1 краплю розчину фенолфталеїну і (по краплях) розчин із с (НАс) = 3 моль/л, поки розчин не знебарвиться (рН = 3-6). Додайте краплю малинового розчину фуксину, що під дією SO2 миттєво знебарвлюється, утворюючи фуксинсірчисту кислоту
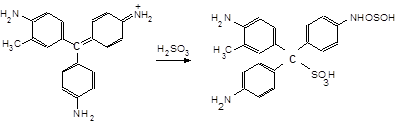
11.14.4. Приклад несумісності аніонів у розчині. У пробірку внесіть декілька кристаликів Na2SO3, трохи розчину Na2S, перемішайте. Додайте рівний об’єм розчину з с (НСl) = 3 моль/л, щоб, перемішавши, здобути кислий розчин. Перемішавши, спостерігаємо поступове помутніння (білого кольору), спричинене виділенням твердої подрібненої елементної сірки.
Записуючи окисно-відновні реакції й розраховуючи lg K, зверніть увагу на зміщення рівноваги у лужному та у кислому середовищі. Зауважте, що тут як окисник виступає один із типових відновників (за табл. 12).
11.15. Реакції іона тіосульфату, S2O32‑.
11.15.1. У пробірці до 2-3 крапель розчину Na2S2O3 додають 1-2 краплі розчину з c (HCl) = 3 моль/л й трохи підігрівають. Кислоти руйнують іон тіосульфату, виділяючи каламуть сірки,
2 H+ + S2O32‑ D S(s) + SO2 + H2O.
11.15.2. В одну пробірку до 2-3 крапель розчину КІ3 додають 2-3 краплі розчину Na2S2O3. В іншу пробірку додають 1-2 краплі розчину з c (H2SO4) = 3 моль/л, 2-3 краплі розчину Na2S2O3 й краплю розчину KMnO4. Спостерігають знебарвлення.
Слабкі окисники (I3‑) переводять S2O32‑ в іон тетратіонату
2 S2O32‑ + I3‑ D S4O62‑ + 3 I‑,
а сильні (MnO4‑) – в іон сульфату
5 S2O32‑ + 8 MnO4‑ + 14 H+ D 10 SO42‑ + 8 Mn2+ + 7 H2O.
Обчисліть константи наведених реакцій.
11.16. Реакції іона сульфату, SO42‑.
11.16.1. У пробірку з 1-2 краплями розчину Na2SO4 додайте рівний об’єм розчину SrCl2 або СаCl2,
Sr2+ + SO42‑ D SrSO4(s), Са2+ + SO42‑ D СаSO4(s).
Додаючи розчин із с (HCl) = 3 моль/л, дослідіть розчинність осаду.
11.16.2. Мікрокристалоскопічна реакція. Пригадайте дослід 2.3.3, що можна виконати, замінивши розчин Н2SO4 на Na2SO4.
11.16.3. Реакція на «сірчану печінь». У порцеляновому тиглі змішайте суху сіль Na2SO4 із потрійною кількістю KNaCO3 та з порошком деревного вугілля (або цукру). Закрийте тигель кришкою, щоб утруднити доступ кисню i ретельно прожарте його на газовому пальнику до топлення. Охолодивши, відокремте шматочок стопу, покладіть на попередньо очищену поверхню cpiбнoї пластинки або монети й змочіть краплею води. Після 3-5 хв. відокремте стоп i розгляньте поверхню монети.
Складіть рівняння реакцій, де вугілля відновлює сполуки сульфуру (сірки), такі як сульфати, до сульфіду, а у реакції на поверхні cpiбла,
Ag(s) – е‑ D Ag+,
бере участь кисень повітря, i в результаті утворюється плівка Ag2S.
11.17. Реакції іона хлориду, Сl‑
11.17.1. Відношення до групових реактивів. Використавши розчин NаС1, упевніться, що з групових реактивів тільки солі Ag+ утворюють осад із С1‑. Пригадайте властивості AgCl(s) (досліди 1.1.2 та 1.1.3).
11.17.2. Відношення до реактиву Фаургольта. Осад AgCl(s) промийте й розділіть на 2 пробірки. До 1‑ї додайте 20 крапель розчину з с (NН3) = 3 моль/л, до 2‑ї – такий же об’єм реактиву Фаургольта (з с (AgNО3) = 0,01 моль/л, с (NН3) = 0,25 моль/л). Відокремте розчини від осаду (якщо останній залишився) й утворіть у них кисле середовище, додавши НNО3. Порівняйте кількість осаду, що випадає в обох випадках. Поясніть це реакцією
Ag+ + 2 NН3 D Ag(NН3)2+,
що обумовлює Ag+− буферні властивості реактиву Фаургольта. Розрахуйте розчинність AgCl(s) у обох пробірках, використовуючи реакцію між осадом і розчином, у якому утворюється переважаючий комплекс Ag(NН3)2+.
11.17.3. Окиснення іона Сl‑. У пробірку вмістіть 4-5 крапель розчину NaCl, додайте 2-3 краплі концентрованої H2SO4, трохи MnO2(s) i нагрійте (під тягою!). До отвору пробірки піднесіть вологий ioдкрохмальний папір. Виділяється хлор, із характерним запахом,
2 Сl‑ + MnO2(s) + 2 Н+ D С12(g) + Мn2+ + 2 Н2О,
С12(g) + 2 I‑ D I2 + 2 Cl‑.
Іодкрохмальний папір синіє.
11.18. Реакції іона хлорату, СlО3‑
11.18.1. Відношення до групових реактивів. Використавши розчин КС1О3, упевніться, що аніон С1О3‑ не дає осадів із груповими реактивами.
11.18.2. Відновлення С1О3‑ до С1‑. Розчин КС1О3 підкисліть сірчаною кислотою, прилийте декілька крапель розчину NaNО2 або FeSO4, підігрійте. Додавши розчин AgNО3, перевірте, чи відновився С1О3‑ до С1‑.
11.19. Реакції іона броміду, Вr‑.
11.19.1. Відношення до групових реактивів. Пригадайте властивості й розчинність бромідів Ca2+, Ba2+, Cd2+ та Ag+.
11.19.2. Відношення до реактиву Фаургольта. Здобувши осад AgBr(s) із розчинів NаBr та AgNО3, здійсніть із ним ті ж операції, що й із AgCl(s) у досліді 11.17.2. Розрахуйте розчинність AgBr(s) у обох пробірках, використовуючи реакцію між осадом і розчином із переважаючим комплексом Ag(NН3)2+, й порівняйте її з оцінками розчинності AgCl(s).
Чи можна реактивом Фаургольта виявити Cl‑ у присутності Br‑?
11.19.3. Окиснення іону Br‑. У пробірку вмістіть 5 крапель розчину KBr i стільки ж розчину з c (H2SO4) = 3 моль/л, потім додайте 3-4 краплі хлороформу або чотирихлористого вуглецю i стільки ж хлорної води, закрийте пробірку пробкою i ретельно струсіть. Спостерігайте за забарвленням шару органічного розчинника в жовтогарячий колір
2 Вr‑ + Сl2 D Br2(CCl4) + 2 Сl‑.
11.19.4. У пробірку вмістіть 4-5 крапель розчину KBr i стільки ж розчину coлi купруму (ІІ), 1-2 краплі розчину із c (NaOH) = 6 моль/л (якщо розчин кислий), по краплях розчин КМnО4 до незникаючого червоно-фіолетового забарвлення, злегка нагрійте
6 Вr‑ + 2 МnО4‑ + 4 Н2О D 3 Вг2 + 2 MnO2(s) + 8 ОН‑,
До отвору пробірки піднесіть фільтрувальний пaпip, змочений розчином флуоресцеїну. Останній, взаємодіючи з випарами брому, перетворюється у трибромфлуоресцеїн (еозин) червоного кольору.

Реакції не заважає іон іодиду, що в цих умовах окиснюється до ІО3‑,
I‑ + 2 МnО4‑ + Н2О D 2 MnO2(s) + IO3‑ + 2 OH‑.
11.20. Реакції іона іодиду, І‑.
11.20.1. Відношення до групових реактивів. Використавши розчин КІ, упевніться, що з групових реактивів тільки солі Ag+ утворюють осад із аніоном І‑. Випробуйте розчинність AgІ(s) у розчині з с (NH3) = 3 моль/л. Випробуйте свій висновок, спробувавши підкислити розчин доданком НNО3, як це робили із осадами AgCl(s) та AgBr(s). Підтвердіть висновок теоретичними оцінками.
Чи можна виявити Cl‑ у присутності І‑, використовуючи розчинність солей арґентуму в амоніаку чи реактиві Фаургольта?
11.20.2. Окиснення іона І‑. (a) У пробірку вмістіть 0,5 мл. дистильованої води, додайте по 1 краплі розчинів із с (КІ) = 0,5 моль/л та c (Н2SО4) = 3 моль/л, 5-8 крапель СНСl3 або СCl4. Додайте кілька крапель хлорної води, закрийте пробірку пробкою i сильно струсіть. Спостерігайте забарвлення орґанічного шару у фіолетовий колір,
2 I‑ + Cl2 D I2(CCl4) + 2 Cl‑.
Надлишок хлорної води окиснює I2 у безбарвну іодновату кислоту, й фіолетове забарвлення зникає,
I2(CCl4) + 5 Cl2 + 6 H2O D HIO3 + 10 H+ + 10 OH‑.
(b) У пробірку вмістіть 2-3 краплі розчину KI, додайте 2-3 краплі розчину з с (НАс) = 6 моль/л та 3-4 краплі розчину з c (NaNO2) = = 2 моль/л. Розчин прокип’ятіть, при цьому І2 видаляється, що можна контролювати вогким папером з розчином крохмалю.
2 NO2‑ + I‑ + 4 НАc D I2 + 2 NO(g) + Ас‑ + 2 Н2О.
11.21. Реакції іона іодату, ІО3‑
11.21.1. Відношення до групових реактивів. Використавши розчин КІО3, випробуйте, з якими розчинами групових реактивів – CaAc2, BaAc2, CdAc2 та AgAс − утворюються осади. Випробуйте розчинність осадів у розчинах із с (НАс) = 3 моль/л, с (НNО3) = 3 моль/л та с (NН3) = 3 моль/л. Розрахуйте константи, що відповідають процесам розчинення.
11.21.2. Дія сульфіту натрію у кислому розчині. У пробірку внесіть трохи розведеного розчину КІО3, додайте краплю розчину з с (H2SO4) = 3 моль/л й одну дрібку твердого Nа2SO3. Додайте приблизно 5 крапель ССl4 й ретельно перемішайте. Про що свідчить колір шару ССl4? Додайте тепер надлишок Nа2SO3 й знову перемішайте. Що змінилося?
Поясніть спостереження, запишіть рівняння реакцій і продумайте, як здійснювати цю реакцію на ІО3‑.
11.21.3. Дія сульфіту роданіду калію у кислому розчині. У пробірку внесіть трохи розчину КІО3, додайте 2 краплі розчину з с (H2SO4) = 3 моль/л, стільки ж розчину КSСN, 5 крапель ССl4 й ретельно перемішайте. Відзначте колір шару ССl4.
Запишіть рівняння реакцій, де SСN‑ перетворюється у НСN (отрута!) та НSО4‑, а ІО3‑ відновлюється до елементного іоду, але не до іодиду. Останнє робить цю реакцію зручнішою порівняно з попередньою.
11.21.4. Проба з іодкрохмальним папером. На іодкрохмальний папір нанесіть краплю розчину КІО3. Якщо змін немає, додайте краплю розчину з с (HСl) = 3 моль/л. Відзначте колір паперу.
Запишіть рівняння реакцій.
Не нашли, что искали? Воспользуйтесь поиском: