
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Орбитальное квантовое число
Не только энергия электрона в атоме (и соответственно размер электронного облака) может принимать определенные значения, но и форма электронного облака не может быть произвольной. Она определяется орбитальным квантовым числом  (его называют еще побочным, или азимутальным). Оно характеризует также различие в энергии электронов в пределах одного уровня (слоя) n и принимает значения
(его называют еще побочным, или азимутальным). Оно характеризует также различие в энергии электронов в пределах одного уровня (слоя) n и принимает значения  = n-1, т.е. от 0 до (n-1). Состояния электрона, характеризующиеся различными значениями
= n-1, т.е. от 0 до (n-1). Состояния электрона, характеризующиеся различными значениями  , называют энергетическими подуровнями электрона в атоме и обозначаются буквами:
, называют энергетическими подуровнями электрона в атоме и обозначаются буквами:
Значение 
| ||||||
| Обозначение | s | p | d | f | g | h |
Таким образом, если n=1, то  =0, т.е. а в пределах первого уровня возможен только s-подуровень;
=0, т.е. а в пределах первого уровня возможен только s-подуровень;
 если n=2, то
если n=2, то  принимает два значения:
принимает два значения:  =0 и
=0 и  =1,т.е. второй энергетический уровень расщепляется на s – и p – подуровни;
=1,т.е. второй энергетический уровень расщепляется на s – и p – подуровни;
 при n=3, то
при n=3, то  принимает три значения:
принимает три значения:  =0 (s–подуровень);
=0 (s–подуровень);  =1 (p-подуровень), и
=1 (p-подуровень), и  = 2 (d-подуровень), т.е. третий энергетический уровень расщепляется на s–, p– и d–подуровни (3 подуровня);
= 2 (d-подуровень), т.е. третий энергетический уровень расщепляется на s–, p– и d–подуровни (3 подуровня);
 при n=4, то
при n=4, то  принимает четыре значения:
принимает четыре значения:  =0 s–подуровень;
=0 s–подуровень;  =1 p-подуровень, и
=1 p-подуровень, и  = 2 d–подуровень,
= 2 d–подуровень,  =3 f – подуровень, т.е. четвертый энергетический уровень расщепляется на s–, p–, d–, f–подуровни (4 подуровня).
=3 f – подуровень, т.е. четвертый энергетический уровень расщепляется на s–, p–, d–, f–подуровни (4 подуровня).
в соответствии с буквенными обозначениями подуровней, электроны, образующие данный подуровень называют s– электронами, p– электронами, d–электронами, f– электронами.
Формы s–, p–, d–, f– электронных облаков приведены на рис.1. Следует, однако, иметь в виду, что электронное облако не имеет резко очерченных границ.
Магнитное квантовое число 
Ориентация электронного облака в пространстве тоже не может быть произвольной. Расположение электронного облака вокруг ядра определяется значением третьего квантового числа, называемого магнитным  .
.
магнитное квантовое число принимает любое целое числовое значение от +  до -
до -  , включая ноль. Всего оно может иметь (2
, включая ноль. Всего оно может иметь (2  +1) значений, т.е. возможно (2
+1) значений, т.е. возможно (2  +1) расположений электронного облака в пространстве.
+1) расположений электронного облака в пространстве.
При  =0
=0 
 = 0, т.е. любые возможные расположения s– электронного облака в пространстве.
= 0, т.е. любые возможные расположения s– электронного облака в пространстве.
При  =1
=1 
 = +1; 0;-1 три значения магнитного квантового числа характеризуют три состояния p–облаков, что соответствует ориентации p–облаков по осям координат х, y, z, их принято обозначать px py pz (рис.1. а)
= +1; 0;-1 три значения магнитного квантового числа характеризуют три состояния p–облаков, что соответствует ориентации p–облаков по осям координат х, y, z, их принято обозначать px py pz (рис.1. а)
|
|
|
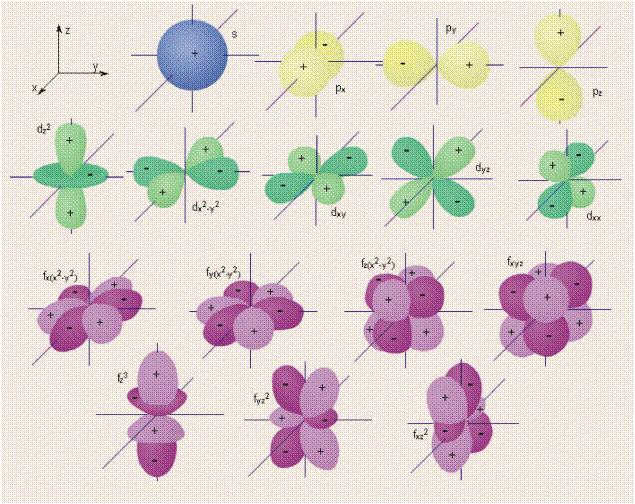 Рис.1. расположение электронных облаков s, p, d и f в пространстве
Рис.1. расположение электронных облаков s, p, d и f в пространстве
При  =2
=2 
 =+ 2; +1; 0;-1;-2 пять значений магнитного квантового числа соответствуют пяти положениям d–облаков в пространстве относительно осей координат (рис.1, б).
=+ 2; +1; 0;-1;-2 пять значений магнитного квантового числа соответствуют пяти положениям d–облаков в пространстве относительно осей координат (рис.1, б).
При  =3
=3 
 =+ 3; + 2; +1; 0;-1;-2,-3 всего семь значений магнитного квантового числа соответствуют семи пространственным положениям f –облаков в пространстве относительно осей координат (рис.1, в).
=+ 3; + 2; +1; 0;-1;-2,-3 всего семь значений магнитного квантового числа соответствуют семи пространственным положениям f –облаков в пространстве относительно осей координат (рис.1, в).
 Состояние электрона в атоме, характеризующееся определенными значениями квантовых чисел n,
Состояние электрона в атоме, характеризующееся определенными значениями квантовых чисел n,  ,
,  , т.е. определенными размерами, формой и ориентацией в пространстве электронного облака, называют атомной орбиталью (АО). Иначе можно сказать, что атомная орбиталь – это область внутриатомного пространства, где с наибольшей вероятностью может находиться электрон, состояние которого описывается определенными значениями квантовых чисел n,
, т.е. определенными размерами, формой и ориентацией в пространстве электронного облака, называют атомной орбиталью (АО). Иначе можно сказать, что атомная орбиталь – это область внутриатомного пространства, где с наибольшей вероятностью может находиться электрон, состояние которого описывается определенными значениями квантовых чисел n,  ,
,  .
.
 Условно АО изображают в виде или в виде.
Условно АО изображают в виде или в виде.
Число АО на подуровне совпадает с числом значений магнитного квантового числа -  . Таким образом, число АО равно единице на s– энергетических подуровнях
. Таким образом, число АО равно единице на s– энергетических подуровнях  ; трем на p–подуровнях
; трем на p–подуровнях  ; пяти на d–подуровнях
; пяти на d–подуровнях  ; семи на f–подуровнях
; семи на f–подуровнях  .
.
Не нашли, что искали? Воспользуйтесь поиском: