
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Зоны повышенной электронной плотности
Рис. 4.10. Образование молекул водорода и хлора при перекрывании двух
сферических - s и двух гантелеобразных - р атомных орбиталей.
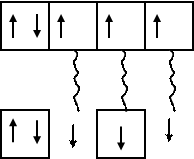
Так, атом азота (7 N …2 s 22 p 3) имеет 3 неспаренных электрона:
 |
S p
Тогда в молекуле азота N 2 между двумя атомами элемента азота будет три пары общих электронов или произойдет перекрывание трех атомных орбиталей:


 N N - электронно-точечная формула молекулы азота
N N - электронно-точечная формула молекулы азота
 N N - структурная формула молекулы азота
N N - структурная формула молекулы азота
 2
2


Перекрывающиеся
атомные орбитали
в молекуле азота
При образовании ковалентной связи по другому (донорно-акцепторному) механизму один атом предоставляет в общее пользование пару электронов, а другой «втягивает» ее на свою свободную атомную орбиталь.
Не нашли, что искали? Воспользуйтесь поиском: