
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Донорно-акцепторный обычный механизм
Механизм образования образования химической


 химической связи связи
химической связи связи

1 s
H+ H H H
Рис. 4.11. Образование иона аммония по донорно-акцепторному механизму.
Таким образом, в ионе аммония у азота 4 общие электронные пары с четырьмя атомами водорода, все четыре связи - ковалентные, но одна возникла по донорно-акцепторному механизму.
По донорно-акцепторному механизму также образуется тетрафторборат aнион 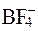 и некоторые другие.
и некоторые другие.
По характеру распределения общего электронного облака относительно ядер двух атомов ковалентную связь подразделяют на:
· ковалентную неполярную,
· ковалентную полярную,
· ионную (часто ионную связь рассматривают как крайний случай ковалентной полярной связи).
Ковалентной неполярной называется связь, образуемая электронным облаком, симметрично расположенным относительно ядер обоих атомов.
Очевидно, что такие атомы должны быть одинаковыми, т.е. иметь одинаковую величину электроотрицательности и характеризоваться одинаковой способностью смещать на себя электронную плотность. Разность относительных электроотрицательностей (см. табл. 14 приложения) в этом случае будет равна нулю.
Если ∆ОЭО = 0, то связь является ковалентной неполярной.
В первую очередь ковалентную неполярную связь имеют атомы в молекулах, состоящих из одинаковых атомов (молекулы типа А2):
H2, O2, CI2 и т.д.
При образовании ковалентной полярной связи общее электронное облако смещено к более электроотрицательному атому. Атом с большей электроотрицательностью сильнее притягивает к себе пару электронов связи, и его истинный заряд становится отрицательным. При этом, атом с меньшей электроотрицательностью приобретает такой же по величине положительный заряд. В этом случае разница в величинах относительных электоотрицательностей атомов (ΔОЭО), образующих химическую связь, должна иметь значение больше нуля, но меньше 1,7 (по Поллингу).
Если 0 > ∆ОЭО < 1,7, то связь является ковалентной полярной.
Обычно ковалентная полярная связь возникает между двумя неметаллами, например в соединениях:
Н2О, NH3, CH4, СО2, НСl.
Ковалентная связь характеризуется насыщаемостью и направленностью. Направленность выражается значениями валентных углов, определяемых расположением атомных орбиталей в пространстве.
Насыщаемость определяется количеством электронов, способных участвовать в образовании связи.
Ионная связь - химическая связь, образующаяся между атомами, характеризующимися большой разницой в величинах относительных электроотрицательностей. При этом общая электронная пара (общая электронная плотность) практически полностью переходит к атому с большей электроотрицательностью и образуются ионы, между которыми возникает электростатическое притяжение:
А×+×В ® А+[:В-].
Разница в величинах относительных электоотрицательностей атомов (ΔОЭО), образующих ионную химическую связь, обычно имеет значение больше 1,7 (по Поллингу).
Если ∆ОЭО > 1,7, то связь считается ионной (степень ионности составляет более 50 %).
Обычно ионная связь возникает между типичными металлами (малая величина относительной электроотрицательности) и типичными неметаллами (большая величина относительной электроотрицательности).
На самом деле, ионная связь между атомами в чистом виде практи-чески не реализуется, а химическая связь, считающаяся ионной, фактически носит частично ионный, а частично ковалентный характер.
Например, в соединении цезия с фтором CsF:
ΔОЭО = ОЭО (F) – ОЭО (Cs) = 4,0 – 0,7 = 3,3.
Cтепень ионности составляет 97 %.
Электростатическое взаимодействие между ионами не направлено в пространстве и поэтому ионная связь, в отличие от ковалентной связи, характеризуется ненаправленостью и ненасыщаемостью.
Водородная связь
Атом водорода, соединенный в молекуле вещества с атомом сильно электроотрицательного элемента (F, O, N), способен к образованию еще одной химической связи с другим сильно электроотрицательным атомом этой же (внутримолекулярная) или другой молекулы (межмолекулярная водородная связь).
Например, в молекуле фтороводорода HF атом с большой электроотрицательностью - фтор смещает на себя электронное облако, приобретая значительный эффективный отрицательный заряд, а ядро атома водорода (протон) практически лишается электронного облака и приобретает эффективный положительный заряд. Между протоном атома водорода и отрицательно заряженным атомом фтора соседней молекулы возникает электростатическое притяжение, что и приводит к образованию водородной связи (см. рис. 4.12).
 F-δ ― Н+δ F-δ ― Н+δ
F-δ ― Н+δ F-δ ― Н+δ

H+δ водородная связь между молекулами фтороводорода
|
F –δ
Рис. 4.12. Схема образования водородных связей в молекулах фтороводорода.
Водородные связи, хотя и слабее ковалентных связей, тем не менее играет очень важную роль во внутри- и межмолекулярных взаимодействиях. Наличие водородной связи способствует процессу ассоциации молекул (объединению в димеры или полимеры), обусловливающим повышенной вязкость, аномально высокие температуры плавления и кипения таких веществ, как вода (см. рис. 4.13), фтороводород, аммиак.
Атом водорода

 Водородная связь
Водородная связь
 |

 Атом кислорода
Атом кислорода
Рис. 4.13. Возникновение водородной связи в молекуле воды
Водородная связь, в значительной мере, определяет свойства спиртов, карбоновых кислот, сложных эфиров, белков и некоторых других органических веществ.
Не нашли, что искали? Воспользуйтесь поиском: