
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
КЛАССИФИКАЦИЯ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Содержание
- Классификация неорганических соединений…………………………………. 4
- Оксиды…………………………………………………………………………… 5
а) основные оксиды………………………………………………………………6
б) кислотные оксиды……………………………………………………………. 7
в) амфотерные оксиды…………………………………………………………..7
- Гидроксиды……………………………………………………………………….9
а) основания……………………………………………………………………....9
б) кислоты………………………………………………………………………...10
в) амфотерные гидроксиды ……………………………………………………..12
- Соли ……………………………………………………………………………….14
а) средние соли……………………………………………………………………14
б) основные соли………………………………………………………………… 16
в) кислые соли ……………………………………………………………………17
5. Примеры выполнения индивидуального задания по теме:
«Классы неорганических соединений»………………………………………….18
6. Примеры выполнения контрольных заданий……………………………..25
Приложение …………………………………………………………………....30
КЛАССИФИКАЦИЯ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Вещества: простые, сложные (соединения).
Простые вещества: металлы, неметаллы, амфотерные элементы;
Металлы: типичные, переходные, лантаноиды, актиноиды.
Типичные: занимают главные |головнаяыхподгруппы 1 и II групп (s – металлы), кроме Ве, Н
Переходные: занимают побочные подгруппы всех групп (d – металлы).
Лантаноиды и актиноиды – занимают нижнюю часть периодической|периодичной| системы (f – металлы).
Неметаллы: Н, B, C, Si а также элементы главных подгруппа V, VI, VII,VIII групп, кроме Bi, Sb.
Амфотерные: Be, A1, Ga, In, Ge, Sn, Pb, Sb,Ві, Zn.
Сложные вещества (соединения): неорганические и органические.
Классы неорганических соединений: оксиды|оксид|, гидроксиды|, соли.
Оксиды – это вещества, которые состоят из двух элементов, один из которых оксиген в степени окисления (-2). Общая формула: Е +n2 O-2n, где n – модуль степени окисления элемента
Виды оксидов: cолеобразующие: основные, кислотные, амфотерные;
несолеобразующие (NO, N2O, CO, SiO).
1) Основные оксиды - это оксиды|оксид|, образованные типичными|типовыми| металлами, или переходными металлами, в степенях| окисления +1, +2.
2) Кислотные оксиды - это оксиды|оксид|, образованные неметаллами во всех, характерных для них степенях| окисления (кроме +1, +2), или переходными металлами в степенях| окисления +5, +6, +7, +8.
3 ) Амфотерные оксиды – это оксиды|оксид|, образованные амфотерными| элементами в любой, характерной для них степени |какому|| окисления, а также переходными металлами в степенях| окисления +3, +4 (+5 Nb, Ta).
4) Несолеобразующие оксиды - это оксиды, которым не соответствуют кислоты.
Это оксиды, не проявляющие ни кислотных, ни основных, ни амфотерных свойств и не образующие соли. Такие оксиды как правило образуют одно - и двухвалентные неметаллы.
Гидроксиды – это гидратированные оксиды. Продукт прямой или косвенной гидратации оксидов.
Виды г идроксидов: основания, кислоты, амфотерные гидроксиды.
1) Основания – продукты прямой или косвенной (непрямой) гидратации основных оксидов. Общая формула: Ме(ОН)n (n = 1;2)
2) Кислоты – это продукты прямой или косвенной (непрямой) гидратации кислотных оксидов: HNO3, H2SO4, H2CO3 и т.д. или продукт растворения в воде газообразных соединений типа: HCl, HBr, HI, H2S, H2Se.
3) Амфотерные гидроксиды - продукт исключительно непрямой гидратации амфотерных оксидов. Общая формула: Ме+n (ОН)n n= 2,3,4(5); Ме+n - катион амфотерного элемента или переходного металла.
Соли – продукт полного или неполного замещения катионов водорода катионами металлов в кислотах, или продукт полного или неполного замещения гидроксогрупп основания кислотными остатками.
Виды солей: основные, кислые, средние, двойные, комплексные.
1). Средние соли – продукт полного замещения катионов водорода катионами металлов в кислотах, или продукт полного замещения гидроксогрупп основания кислотными остатками.
2). Основные соли – это продукт неполного замещения гидроксогрупп многокислотных оснований кислотными остатками.
3). Кислые соли -это продукт неполного замещения катионов Гидрогена в молекулах многоосновных кислот катионами металла.
4). Д войные соли — это соли, содержащие два типа катионов. Примером является KAl(SO4)2·12H2O (алюмокалиевые квасцы). Двойные соли существуют только в твердом виде. При растворении в воде они диссоциируют на ионы, например: KAl(SO4)2 = К+ + Al3+ + 2SO42−
5). Комплексные соли - это соединения, в состав которых входит комплексный (координационный) ион, образовавшийся в результате донорно-акцепторного взаимодействия атома (иона) комплексообразователя и лиганд (анионы или нейтральные молекулы).
ОКСИДЫ|оксид|
1. Определение: оксиды – это вещества, которые состоят из двух элементов, один из которых Оксиген в степени окисления (-2).
2. Состав: Е +n2 O-2n, где n – модуль степени окисления элемента
3. Номенклатура:
К2О – калий оксид.
Валентность калия не указывается, так как элементы главных подгрупп I,II,III групп (кроме Tl) имеют практически постоянную степень окисления, и следовательно, единственный состав оксида.
С+4О2 – карбон (IV) оксид,
где ((IV) – валентность карбона, численно равная модулю степени окисления карбона.
4. Графическая формула – это формула, в которой черточка между элементами соответствует общей электронной паре, посредством которой атомы соединяются друг с другом. Число черточек от каждого атома соответствует его валентности для соединений с ковалентным типом связи или модулю степени окисления для ионных соединений.
К – О – К; О = С = О.
5. Типы связей: С – О – ковалентная| полярная,
Немет Немет
К – О – преимущественно ионная
Мет Немет | | | |
6. Физические свойства.
Основные и амфотерные оксиды – это соединения, образованные по преимущественно ионному типу связи. Это твердые, хрупкие кристаллические вещества. Теплопроводность средняя. Диэлектрики. Нелетучие.
Кислотные оксиды – это соединения, образованные по ковалентному полярному типу связи. Большинство этих соединений газы (исключение составляют твердые вещества: B2O3, SiO2, P2O3, P2O5, SO3, N2O5).
7. Химические свойства.
Вещества, близкие по свойствам друг с другом | практически|практично| не реагируют.
Вещества, |какие| отличающиеся по|разнятсядруг от друга по свойствам, реагируют друг с другом тем активнее, чем глубже различия|разность| в свойствах.
План изложения.
7.1. Отношение к|до| воде.
7. 2. Взаимодействие с оксидами|оксидом|.
7.3. Взаимодействие с |с| гидроксидами|.
7.4. Взаимодействие с солями.
7.5. Взаимодействие с металлами.
7.6. Термолиз
8. Получение.|
ОСНОВНЫЕ ОКСИДЫ -
это оксиды|оксид|, образованные типичными|типовыми| металлами, или переходными металлами, в степенях| окисления +1, +2.
Например: Na2O, Li2O, MgO, CaO, MnO, FeO, TiO
7.1. С водой реагируют только оксиды|оксид| типичных|типовых| металлов.
Ме2Оn + H2O à 2Me(OH)n
прямая гидратация|
Ме – подгруппы лития и магния. Все другие основные оксиды|оксид| с водой не реагируют.
7.2. С оксидами|оксидом|:
а) кислотными K2O + SiO2 à K2SiO3
основный кислотный
б) амфотерними MnO + A12O3 à Mn(A1O2)2
основный амфотерный,
как кислотный
|
7.3. С|с| гидроксидами|:
а) кислотами MgO + H2SO4 à MgSO4 + H2O
б) амфотерними гидроксидами 3Rb2O + 2Cr(OH)3 à 2Rb3CrO3 + 3H2O
основный амфотерный,
как кислота H3CrO3
7.4. С солями не реагируют.
7.5. С металлами высокой химической активности.
FеO| + Ca| → CаO| + Fe|
КИСЛОТНЫЕ ОКСИДЫ -
это оксиды|оксид|, образованные неметаллами во всех, характерных для них степенях| окисления (кроме +2), или переходными металлами в степенях| окисления +5, +6, +7, +8.
Например: CO2, SO2, SO3, N2O5, P2O5, Cl2O7, Mn2O7, CrO3
7.1. С водой реагируют все кроме: SiO2, WO3, Ta2O5, Nb2O5
SO3 + H2O à H2SO4
7.2. С оксидами: а) основными SiO2 + CaO à CaSiO3
кислотный основный
б) амфотерными N2O5 + ZnO à Zn(NO3)2
кислотный амфотерный,
как основный|
7.3. С гидроксидами:
а) основаниями SiO2 + 2 NaOH à Na2SiO3 + H2O
б) амфотерними гидроксидами
SO2 + Zn(OH)2 à ZnSO3 + H2O
кислотный амфотерный, как основание
7.4. С солями не реагируют.
7.5. С металлами не реагируют.
АМФОТЕРНЫЕ ОКСИДЫ –
это оксиды|оксид|, образованные амфотерными| элементами в любой, характерной для них степени |какому|| окисления, а также переходными металлами в степенях| окисления +3, +4, +5.
Например: BeO, ZnO, Al2O3, Ga2O3, GeO, PbO, PbO2, SnO, SnO2, Fe2O3, Cr2O3, Mn2O3, MnO2, Nb2O5
7.1. С водой не реагируют и не растворяются.
7.2. С оксидами: t0
а) основными A12O3 + MgO à Mg(A1O2)2
амфотерный, основный
как кислотный| t0
б) кислотными Cr2O3 + N2O5 à 2Cr(NO3)3
амфотерный, кислотный
как основный|
в) амфотерними A12O3 + ZnO à Zn(A1O2)2
амфотерный,| амфотерный,
как кислотный как основный|
BeO + TiO2 à BeTiO3
амфотерный,| амфотерный,
как основный как кислотный
7.3. С гидроксидами:
а) основаниями Cr2O3 + 2NaOH à 2NaCrO2 + H2O
t0
ZnO + 2NaOH + H2O à Na2 [Zn(OH)4]
t0
б) кислотами In2O3 + 6HC1 à 2InC13 + 3H2O
в) амфотерными гидроксидами
t0
2ZnO + Pb(OH)4 à Zn2PbO4 + 2H2O
амфотерный,| амфотерный,
как основный как кислотный
7.4. С солями не реагируют.
7.5. С металлами: восстанавливаются|восстанавливают| более активными металлами
Fe2O3 + 2Аl à Al2O3 + 2Fe
8. Способы получения оксидов|оксида|:
а) окисление: простых веществ 2Mg + O2 à 2MgO
4P + 5O2 à 2P2O5
сложных веществ 2H2S + 3O2 à 2H2O + 2SO2
СН4 + О2 = СО2 + 2 Н 2О
доокисление оксидов 2 SO2 + O2 = 2 SO3
б) разложение: солей (кроме солей щелочных металлов)
t0
CuSO4 à CuO + SO3
t0
гидроксидов Са(ОН)2 à СаО + Н2О
t0
H2SO3 à SO2 + H2O
t0
Zn(OH)2 à ZnO + H2O
ГИДРОКСИДЫ
Гидроксиды: основания, кислоты, амфотерные гидроксиды.
Гидроксиды – это гидратированные оксиды. Продукт прямой или косвенной гидратации оксидов.
ОСНОВАНИЯ|основание|
1. Определение: Основания – продукты прямой или косвенной (непрямой) гидратации основных оксидов.
2. Состав: Ме(ОН)n (n = 1;2) Основания, в которых n = 1 называются однокислотными, при n = 2 - двукислотными.
3. Номенклатура: КОН – калий гидроксид; Ва(ОН)2 – барий гидроксид; Fe(ОН)2 – феррум (II) гидроксид.
4. Графическая формула К – О - Н
5. Типы связи: К – О – преимущественно ионная, О – Н –ковалентная| полярная.
мет. немет. немет. немет.
6. Физические свойства: Все основные соединенмя твердые. Основания, образованные металлами главной подгруппы I группы и подгруппы бария вещества кристаллические. При нагревании плавятся без разложения. Все остальные – аморфные. При нагревании разлагаются.
7. Химические свойства:
7.1 Отношение к воде: а) растворимые; б) нерастворимые.
а) растворимые или щелочи – образованы металлами главной подгруппы I группы и подгруппы кальция. Диссоциируют в водных растворах по типу сильных электролитов: нацело и необратимо.
Ме(ОН)n à Me+n + nOH-
б) трууднорастворимые основания - образованы магнием или d – металлами в степени окисления +1, +2. Диссоциируют |основа| по типу слабых электролитов|основания|: ступенчато и обратимо.
Me(ОН)n ↔ Me+n(OH)+n-1 + OH- 1 ступень
Me+n(OH)+n-1 ↔ Me+n(OH)+n-2 + OH- 2 ступень
Me+n(OH)+n-2 ↔ Men+ +(n-2) OH- n - ступень
7.2 Взаимодействие с| оксидами:
t0
а) кислотными 2КОН + SiO2 à K2SiO3 + H2O
б) амфотерными Sr (OH)2 + A12O3 à Sr (A1O2)2 + H2O
7.3 Взаимодействие с гидроксидами:
а) кислотами Mg(OH)2 + H2SO4 à MgSO4 + 2H2O
б) амфотерными| гидроксидами|
Са (OH)2 + Pb(OH)2 à Cа PbO2 + 2H2O
7.4 Взаимодействие с солями (реагируют в растворах только щелочи)
2NaOH + CuSO4 à Cu(OH)2 ↓ + Na2SO4
7.5 С | металлами амфотерными реагируют только щелочи
2NaOH + Zn + 2H2O à Na2[Zn(OH)4] + H2
7.6 Термолизу подлежат только аморфные основания|основание|
to
Fe (OH)2 à FeO + H2O
8. Получение:
а) прямая гидратация| металлов (подгруппы Li|, Ca|)
Me + H2O à Me(ОН)n + H2
б) прямая гидратация| оксидов|оксида| металлов(подгруппы Li|, Ca|)
K2O + H2O à 2KOH
в) косвенная гидратация| в результате ионного обмена ионного обмена
FeC12 + 2NaOH à Fe(ОН)2 ↓ + 2 NaCl
КИСЛОТЫ
1.Определение
а) Кислородсодержащие (кислородные) кислоты – это продукты прямой или косвенной (непрямой) гидратации кислотных оксидов: HNO3, H2SO4, H2CO3 и т.д.
б) Бескислородные – это продукт растворения в воде газообразных соединений типа:
HCl, HBr, HI, H2S, H2Se и т.п..
Одноосновные кислоты содержат в составе|складе| один атом гидрогена HNO3,| HCl.
Многоосновные кислоты содержат два и более атомов гидрогена H2SO4 , H3PO4.
2. Состав: молекулы кислот состоят из катионов Н+ и кислотных остатков.
3. Номенклатура:
а)названия кислородсодержащих | кислот начинаются с латинского названия кислотообразующего элемента с добавлением|додает| суффикса- ат -|, если элемент находится в максимальной для него степени окисления, или - ит| -, если элемент имеет промежуточную степень окисления и последующего добавления|додает| окончания – ная и слова кислота.
H2S+4 O3 - сульфитная кислота; H2S+6O4 - сульфатная кислота.
б) бескислородные кислоты – латинское название неметалла, суффикс – ид | -, окончание –ная|, и слово кислота.
H2S - сульфидная кислота; HBr – бромидна кислота.
I I
4. Графическая формула Н + С1- Н С1 Н – С1
При составлении графических формул кислородных кислот следует учитывать, что присоединение атомов гидрогена к кислотообразующему элементу осуществляется только через атом Оксигена.
I VI II I V II
H2+ S+6O4-2 H2 S O4 H+ N+5 O3-2 H N O3
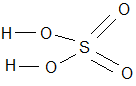
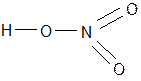
I, VI, V, II - валентность
5. Типы связи: Н – С1 - ковалентная| полярная, Н – О – ковалентная| полярная, N – О – ковалентная| полярная, S – O - ковалентная| полярная.
6. Физические свойства: жидкие, твердые (H3PO3, H3PO4, H2WO4, HNbO3, HTaO3, Н3ВО3 ); гелеобразная – H2SіO3, некоторые существуют только в растворах (H2SO3, H2CO3).
7. Химические свойства:
7.1 При взаимодействии с водой диссоциируют с образованием катионов Н+ по типу сильных или слабых электролитов. См. табл. №2 Степени диссоциации кислот.
H2O
а) Н С1 → Н+ + С1- сильный электролит
б) H2 S O4 → H+ + НSO4- сильный электролит
НSO4 - ↔ H+ + SO42- слабый электролит
H2 S O4 → 2H+ + SO42-
7.2 Взаимодействие с оксидами:
а) основными MgO + H2SO4 à MgSO4 + H2O
б) амфотерными In2O3 + 6HC1 à 2InC13 + 3H2O
7.3 Взаимодействие с гидроксидами:
а) основаниями Mg(OH)2 + H2SO4 à MgSO4 + 2H2O
б) амфотерными гидроксидами
3H2SO4 + 2Fe(OH)3 à Fe2(SO4)3 + 6H2O
7.4 Взаимодействие с солями: в растворах при условии образования труднорастворимых | солей или летучих веществ
H2SO4 + BaC12 àBaSO4 ↓ + 2HC1
Na2CO3 + 2HCl à 2NaCl + H2O + CO2↑
7.5 Взаимодействие с металлами:
а) кислоты слабые окислители (HCl, HBr, HI, H2SO4 разб.) взаимодействуют с металлами, стоящими в ряду активности металлов до водорода. В результате взаимодействия образуется соль и водород.
H2SO4 + Zn → ZnSO4 + H2 ↑ ||д|
2HC1 + Mg à MgC12 + H2 ↑
б) кислоты сильные окислители (H2SO4 конц., HNO3) реагируют со всеми металлам, кроме золота и платиновых. При взаимодействии образуется соль, вода и продукт восстановления кислородсодержащего элемента:
Для H2S+6O4: S+6 → S+4 → S0 → S-2
Для HN+5O3 : N+5 → N+4 → N+2 → N+1 → N0 → N-3
Чем активнее металл, с которым реагирует кислота, тем глубже восстановление.
4H2S+6O4 + 3Zn0 → 3Zn+2SO4 + 4H2O + S0
концентрированная
5H2S+6O4 + 4Mg0 → 4Mg+2SO4 + 4H2O + H2 S-2
8HN+5O3 + 3Zn0 → 3Zn+2(NO3)2 + 4H2O + 2N+2O
10HN+5O3 + 4Mg0 → 4Mg+2(NO3)2 + 3H2O + N-3H4NO3
7.6 При нагревании кислородсодержащие | кислоты разлагаются |разлагают|
H2SiO3 à H2O + SiO2
H2SO4 à H2O + SO3
8. Способы получения:
а) бескислородные кислоты получают путем растворения в воде газов состава HCl, HBr, HI, H2S.
H2 + I2 à 2HI
б) прямая гидратация| соответствующих оксидов|оксида
SO3 + H2O à H2SO4
в) непрямая гидратация| в результате|вследствие| ионного обмена:
Na2WO4 + 2HCl → 2NaCl + H2WO4↓
CaCl2 + H2CO3 → CaCO3 + 2HCl
г) общий способ – реакция обмена между солью и менее| летучей кислотой:
NaC1 + H2SO4 à HC1 ↑+Na2SO4
Не нашли, что искали? Воспользуйтесь поиском: