
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Пример выполнения индивидуального задания по теме
«Классы неорганических соединений»
Задание: Охарактеризовать физические и химические свойства оксидов и гидроксидов (по одному представителю каждого вида).
ОСНОВНЫЕ ОКСИДЫ
1. Определение: Основные оксиды - это оксиды|оксид|, образованные типичными|типовыми| металлами, или переходными металлами, в степенях| окисления +1, +2.
2. Состав: Na2О
3. Номенклатура: Na2О – Натрий оксид
I II
4. Графическая формула: Na2О Na – О – Na
5. Типы связей: Na – О – преимущественно ионная
мет немет | | | |
6. Физические свойства: это твердое, кристаллическое хрупкое вещество
7. Химические свойства.
7.1. Взаимодействует с водой. |
Na2О + H2O à 2NaOH
7.2. С оксидами|оксидом|:
а) кислотными Na2O + SiO2 à Na2SiO3
основный кислотный
б) амфотерными Na2O + A12O3 à 2 NaA1O2
основный амфотерный,
как кислотный|
7.3. С|с| гидроксидами|:
а) кислотами Na2O + H2SO4 à Na2SO4 + H2O
б) амфотерними гидроксидами 3Na2O + 2Cr(OH)3 à 2Na3CrO3 + 3H2O
основный амфотерный,
как кислота
7.4. С солями не реагируют.
7.5. С металлами более высокой химической активности Na2O + К à К2O + Na|
8. Способ получения|оксида|:
а) окисление простых веществ 2 Na + O2 à Na2O2
б) Na2O2 + 2Na → 2Na2O
КИСЛОТНЫЕ ОКСИДЫ -
1.Определение: Кислотные оксиды - это оксиды|оксид|, образованные неметаллами во всех степенях| окисления (кроме +2), или переходными металлами в степенях| окисления +5, +6, +7, +8.
2. Состав: СО2
3. Номенклатура: Карбон (IV) оксид.
4. Графическая формула: О = С = О
5. Тип связи: С – O – ковалентная полярная
немет немет
6. Физические свойства: газ без цвета и запаха, с низкой температурой плавления и кипения, низкая теплопроводность. Электропроводимость отсутствует. Характерна летучесть.|электропроводность|
7. Химические свойства:
7.1. Взаимодействие с водой:
СО2 + H2O à H2СO3
7.2. С оксидами: а) основными СО2 + CaO à CaСO3
кислотный основный
б) амфотерными СО2 + ZnO à ZnСO3
кислотный амфотерный,
как основный|
7.3. С гидроксидами: а) основаниями
СО2 + 2NaOH à Na2СO3 + H2O
б) амфотерними гидроксидами
СО2 + Zn(OH)2 à ZnСO3 + H2O
кислотный амфотерный,
как основание
7.4. С солями не реагируют.
7.5. С металлами не реагируют.
8. Способы получения|оксида|:
а) окисление простых веществ C + O2 à CO2
б) разложение: солей CaСO3 à CaO + CO2
гидроксидов H2СO3 à СО2 + H2O
АМФОТЕРНЫЕ ОКСИДЫ
1. Определение: Амфотерные оксиды -это оксиды|оксид|, образованные амфотерными| элементами в любой степени |какому|| окисления, а также переходными металлами в степенях| окисления +3, +4.(Nb2 O5, Ta2 O 5)
2. Состав: A12O3
3. Номенклатура: Алюминий оксид.
4. Графическая формула: O = AI - O - AI = O
5. Тип связи: A1 – O – ковалентная полярная
мет немет
6. Физические свойства: Это твердое, кристаллическое хрупкое вещество.
7. Химические свойства:
7.1. С водой не реагирует и не растворяется.
7.2. С оксидами:
а) основными A12O3 + MgO à Mg(A1O2)2
амфотерный, основный
как кислотный|
б) кислотными A12O3 + N2O5 à 2 A1(NO3)3
амфотерный, кислотный
как основный|
в) амфотерними A12O3 + ZnO à Zn(A1O2)2
амфотерный,| амфотерный,
как кислотный как основный|
7.3. С гидроксидами:
а) основаниями A12O3 + 2NaOH à 2NaA1O2 + H2O
б) кислотами A12O3 + 6HC1 à 2 A1C13 + 3H2O
в) амфотерными гидроксидами
2A12O3 + 3Pb(OH)4 à A14(PbO4)3 + 6H2O
7.4. С солями не реагируют.
7.5. С металлами – восстанавливаются|восстанавливают| более активными металлами
A12O3 + 3Са à 3СаO + 2A1
8. Способы получения|оксида|:
а) окисление: простых веществ 4 Al + 3O2 à 2Al2O3
б) разложение: солей Al2(SO4)3 à Al2O3 + 3SO3
гидроксидов 2 Al(OH)3 à Al2O3 + 3H2O
ГИДРОКСИДЫ
Гидроксиды: основания, кислоты, амфотерные гидроксиды.
Гидроксиды – это оксиды, которые содержат воду.
ОСНОВАНИЯ|основание|
1.Определение:Основания– продукты прямой или косвенной (непрямой) гидратации основных оксидов.
2.Состав: Ba(ОН)2
3. Номенклатура: Ва(ОН)2 – Барий гидроксид
4. Графическая формула: Н – О – Ва – О - Н
5. Типы связи: Ba – О – преимущественно ионная, О – Н –ковалентная| полярная.
6. Физические свойства|стан|: твердое, кристаллическое хрупкое вещество.
7. Химические свойства:
7.1. В водных растворах диссоциирует с отщеплением ОН-:
Ва(ОН)2 à Ва+2 + 2OH-
7.2 Взаимодействие с|с| оксидами:
а) кислотными Ва(ОН)2 + SO2 à ВаSO3 + H2O
t0
б) амфотерными Ва(OH)2 + A12O3 à Ва(A1O2)2 + H2O
7.3 Взаимодействие с гидроксидами:
а) кислотами Ва(OH)2 + H2SO4 à ВаSO4 + 2H2O
б) амфотерными| гидроксидами|
Ва(OH)2 + Pb(OH)2 à ВаPbO2 + 2H2O
7.4 Взаимодействие с солями:
Ва(ОН)2 + CuCl2 à Cu(OH)2 ↓ + BaCl2
7.5 Взаимодействие с амфотерными| металлами
Ва(ОН)2 + Zn + 2H2O à Ва[Zn(OH)4] + H2
8. Получение:
а) прямая гидратация| металла
Ва +2H2O à Ва(ОН)2 + H2
б) прямая гидратация| оксида|оксида| металла
ВаO + H2O à Ва(ОН)2
КИСЛОТЫ
1.Определение: Кислоты – это продукты прямой или косвенной (непрямой) гидратации кислотных оксидов.
2. Состав: HNO3
3. Номенклатура: нитратная кислота
4. Графическая формула
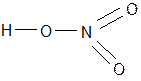
5. Типы связи: Н – О – ковалентная| полярная, N – О – ковалентная| полярная.
6. Физические свойства: жидкость.
7. Химические свойства:
7.1 При взаимодействии с водой диссоциируют с отщеплением Н+
HNO3 → H+ + NO3-
7.2 Взаимодействие с оксидами:
а) основными MgO + 2HNO3 à Mg (NO3)2 + H2O
б) амфотерными In2O3 + 6HNO3 à 2In(NO3)3 + 3H2O
7.3 Взаимодействие с гидроксидами:
а) основаниями Mn(OH)2 + 2HNO3 à Mn (NO3)2 + 2H2O
б) амфотерными гидроксидами
3HNO3 + Fe(OH)3 à Fe(NO3)3 + 6H2O
7.4 Взаимодействие с солями: в растворах при условии образования труднорастворимых | солей или летучих веществ
Na2CO3 + 2HNO3 à 2NaNO3+ H2O + CO2↑
7.5 Взаимодействие с металлами: Нитратная кислота взаимодействует со всеми металлами, кроме золота и платиновых. Состав продуктов зависит от активности металла и концентрации кислоты:
Металл высокой химической активности:
4Mg + 10HNO3(конц.) = 4Mg(NO3)2 + N2O + 5H2O
4Mg +10HNO3 (разбавл.) = 4Mg(NO3)2 + NH4NO3 + 3H2O
Металл низкой химической активности:
Сu + HNO3(конц.) = Cu(NO3)2 + 2NO2 +2H2O
3Cu + 8HNO3(разб.) =Cu(NO3)2 + 2NO + 4H2O
7.6 При нагревании кислородсодержащие | кислоты разлагаются|разлагают|
2HNO3 à N2O5 + H2O
8. Способы получения:
прямая гидратация| соответствующего оксида|оксида
N2O5 + H2O à 2HNO3
Не нашли, что искали? Воспользуйтесь поиском: