
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Получение кислот (слайд 18)
Оксид неМе + Н2О → кислота
* Исключение оксид кремния (IV) SiO2, который с водой не реагирует
SO3 + H2O → H2SO4
SO2 + H2O → H2SO3
Химические свойства кислот
1.Кислота + Ме → соль + Н2↑ (слайд 21)
Обратите внимание!
Для реакции не брать азотную кислоту HNO3
и конц. серную кислоту H2SO4, а также металлы, стоящие в ряду активности до Н2, т.к. они реагируют иначе.
Zn + 2HCl → ZnCl2 + H2↑
Mg + H2SO4 → MgSO4 + H2↑
2. Кислота + оксид Ме → соль + Н2О (слайд 22)
2HCl + CaO → CaCl2 + H2O
H2SO4 + CuO → CuSO4 + H2
6HNO3 + Al2O3 → 2Al(NO3)3 + 3H2O
3. Основание + кислота → соль + Н2О (реакция нейтрализации) (слайд 23)
NaOH + HCl → NaCl + H2O
2KOH + H2SO4 → K2SO4 + 2H2O
4. Основание + кислота → соль + Н2О (реакция нейтрализации)
NaOH + HCl → NaCl + H2O
2KOH + H2SO4 → K2SO4 + 2H2O
5. Соль + кислота → др. соль +другая кислота (слайд 24)
(↑ или ↓)
Обратите внимание!
Реакция обмена протекает до конца только в том случае, если образуется осадок (↓) или выделяется газ (↑)
AgNO3 + HCl → AgCl ↓ + HNO3
Соли - сложные вещества, состоящие из атома металла и кислотного остатка (слайд 11)
Вспомним классификацию солей (слайд 12)
Преподаватель предлагает студентам составить формулы солей:
сульфат бария, карбонат калия, нитрат алюминия III, хлорид железа II, сульфид натрия, гидроксохлорид меди II, гидросульфид натрия. Работа с алгоритмом составления формул солей.
Получение солей
1.Me + неМе → соль (слайд 14)
2 Al + 3Cl2→ 3AlCl3
2.Кислота + Ме → соль + Н2↑ (слайд 21)
Обратите внимание!
Для реакции не брать азотную кислоту HNO3
и конц. серную кислоту H2SO4, а также металлы, стоящие в ряду активности до Н2, т.к. они реагируют иначе.
Zn + 2HCl → ZnCl2 + H2↑
3.Основание + кислота → соль + Н2О (реакция нейтрализации) (слайд 23)
NaOH + HCl → NaCl + H2O
4. Кислота + оксид Ме → соль + Н2О (слайд 22)
2HCl + CaO → CaCl2 + H2O
Химические свойства солей:
1. Соль + кислота → др. соль +другая кислота (слайд 24)
(↑ или ↓)
Обратите внимание!
Реакция обмена протекает до конца только в том случае, если образуется осадок (↓) или выделяется газ (↑)
AgNO3 + HCl → AgCl ↓ + HNO3
2. Соль + Ме → др. соль + др. Ме (слайд 25)
Обратите внимание!
Реакция протекает в соответствии с положением металла в ряду активности: более активный металл вытесняет менее активный из раствора его соли. (см. ряд активности)
CuSO4 + Fe → FeSO4 + Cu
3. Соль + основание → другая соль + другое основание ↓ (слайд 26)
Обратите внимание!
* В реакцию ступают только растворимые соли и щелочи
* Реакция протекает до конца, если полученное основание
является нерастворимым (выпадает в осадок)
CuSO4 + 2NaOH → Na2SO4 + Cu(OH)2↓
4. Соль + соль → две новые соли (↓) (слайд 27)
Обратите внимание!
Реакция обмена протекает до конца, если одна из образующихся солей выпадает в осадок (↓)
AgNO3 + NaCl → AgCl↓ + NaNO3
Контроль знаний
Выполнение теста (слайд 28 – 37).
2.5. Домашнее задание
1. Напишите уравнения реакций нейтрализации, в результате которых образуются соли:
а) AlCl3;
б) BaSO4.
2. Допишите уравнения тех реакций, которые идут до конца:
а) NaOH + HCl 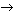 …
…
б) CuCl2 + KOH 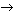 …
…
в) NaOH + CaO 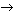 …
…
г) Сu + HCl 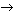 …
…
Не нашли, что искали? Воспользуйтесь поиском: