
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Элементы VIIB группы
Марганец Мn, технеций Тс и рений Re — элементы-аналоги, образующие группу VIIB.
Из элементов VIIB-группы только марганец является биогенным элементом и одним из десяти металлов жизни, необходимых для нормального протекания процессов в живых организмах.

Калий перманганат KMnO4 — наиболее известное соединение марганца, применяемое в медицине. Используют водные растворы с содержанием КМnО4 от 0,01 до 5%, В качестве кровоостанавливающего средства применяют 5%-ный раствор. Растворы калия перманганата обладают антисептическими свойствами, которые определяются его высокой окислительной способностью.
Перманганат КМnО4 хорошо растворим в воде. Перманганаты — сильные окислители. Это свойство используется в медицинской практике для дезинфекции, в фармакопейном анализе для идентификации Н2О2 путем взаимодействия с КМnО4 в кислой среде (перманганатометрия). Количественное содержание КМnО4 в препаратах Государственная фармакопея рекомендует определять иодометрически путем проведения реакции с KI в кислой среде.
Глубина превращения перманганата зависит от рН среды, в которой протекает реакция. При сравнении стандартных окислительно-восстановительных потенциалов видно, что наиболее сильные окислительные свойства перманганат-ион проявляет в кислой среде:
МnО4– + 8Н++5е =Мn2+ + 4Н2О; 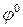 = 1,52 В
= 1,52 В
МnО4– +2H2O+3e = MnO2 +4OH–; 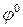 = 1,23В
= 1,23В
МnО4– + 1е = МnО42– ; 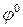 =0,56 В
=0,56 В
Высокую окислительную способность перманганата используют в экологии для оценки загрязненности сточных вод (перманганатный метод). По количеству окисленного (обесцвеченного) перманганата определяют содержание органических примесей в воде. Перманганатный метод (перманганатометрию) используют также в клинических лабораториях для определения содержания мочевой кислоты в крови.
Вследствие высокой окислительной способности кислородные соединения марганца в высших степенях окисления в организме не существуют.
Для организма перманганаты являются ядами, их обезвреживание может происходить следующим образом:
2КМnО4+5Н2О2+6Н+ =2Мn2++2К+ +8Н2О+5О2
Для лечения острых отравлений перманганатом используется 3%-ный водный раствор Н2О2, подкисленный уксусной кислотой.
Калий перманганат окисляет органические вещества клеток тканей и микробов. При этом КМnO4 восстанавливается до МnО2 Марганец (IV) оксид может также взаимодействовать с белками, образуя комплекс бурого цвета.
Под действием калия перманганата КМnО4 белки окисляются и свертываются (коагулируют). На этом основано его применение в качестве наружного препарата, обладающего противомикробными и прижигающими свойствами. При этом его действие проявляется только на поверхности кожи и слизистых оболочек. Окислительные свойства водного раствора КМnО4 используют для обезвреживания токсичных органических веществ. В результате окисления образуются менее токсичные продукты. Например, наркотик морфин превращается в биологически малоактивный оксиморфин.
Из других соединений марганца следует отметить марганец (II) сульфат и марганец (II) хлорид, которые используют при лечении малокровия.
В теле взрослого человека содержится 12 мг (1,6  10–5 %). Марганец концентрируется в костях (43%), остальное — в мягких тканях, в том числе и в мозге.
10–5 %). Марганец концентрируется в костях (43%), остальное — в мягких тканях, в том числе и в мозге.
В организме марганец образует металлокомплексы с белками, нуклеиновыми кислотами, АТФ, АДФ, отдельными аминокислотами. Содержащие марганец металлоферменты: аргиназа, холинэстераза, фосфоглюкомутаза, пируваткарбоксилаза.
Связывание аммиака — токсичного продукта превращения аминокислот в организме млекопитающих осуществляется через аминокислоту аргинин. Аргиназа — фермент, катализирующий в печени гидролиз аргинина. В результате аргинин расщепляется на мочевину и циклическую аминокислоту орнитин:

Мочевина — нетоксичное, растворимое в воде вещество. Оно потоком крови доставляется в почки и выводится с мочой.
Атомный радиус марганца 128 пм. Это объясняет то обстоятельство, что марганец может замещать магний (атомный радиус 160 пм) в его соединении с АТФ, существенно влияя на перенос энергии в организме.
Гидролиза аденозинтрифосфата (АТФ) до аденозиндифосфата (АДФ) обеспечивает энергетику жизнедеятельности. В организме этот процесс активируется магнием в результате образования комплексов МgАТФ2– и MgAДФ–. Однако установлено, что активацию могут осуществлять и ионы марганца Мn2+. При этом оказывается, что комплексы МnАТФ2– и МnАДФ– более активны. Участие марганца в гидролизе можно представить в виде:

Ионы Mg2+ и марганца Мn2+ осуществляют также активацию ферментов — нуклеаз. Эти ферменты катализируют в двенадцатиперстной кишке гидролиз нуклеиновых кислот ДНК и РНК. В результате эти биополимеры расщепляются на мономерные единицы — нуклеотиды. В частности такой нуклеазой является дезоксирибонуклеаза, которая катализирует гидролиз ДНК только в присутствии ионов Mg2+ или Мn2+.
Марганец может входить и в состав неорганических соединений организма. Это, например, малорастворимый марганец магний пирофосфат MnMgP2O7. Кристаллы этой соли локализуются на внутренней поверхности мембраны везикул.
Почти одинаковое значение атомного радиуса марганца (128 пм) и железа (126 пм) объясняет способность марганца замещать железо в порфириновом комплексе эритроцита. По той же причине марганец может замещать и цинк (атомный радиус 127 пм) в цинкзависимых ферментах, изменяя при этом их каталитические свойства.
О наличии технеция в живых организмах данных нет. Однако соединения технеция с бисфосфонатами используют для радио-изотопного метода диагностики. Метастабильный изотоп технеция 99Тс является излучителем лучей. В первые минуты после внутривенного введения препарата «Технефор», содержащего 99Тс, можно исследовать состояние мягких тканей, через 2—3 ч после введения — костных. Ниже приводится формула строения комплекса Тс с бисфосфонатом:
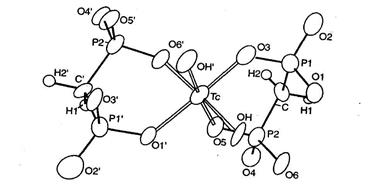
В соединении с бисфосфонатом технеций обычно четырехвалентен, при этом координационное число может быть равным 6, что хорошо видно на схеме.
Таким образом, для решения медико-биологических задач используются не только соединения жизненно необходимого Мn, но и соединения искусственного элемента 99Тс.
§5. VIII Б-группы (семейство железа и семейство платины)
В VIIIB-группе периодической системы расположены химические элементы — переходные металлы: Fe, Co, Ni, Rn, Rh, Pd, Os, Ir, Pt.
По распространенности в природе, применению соединений в медицине и технике и роли в организме железо стоит на первом месте в VIIIB-группе.
Железо Fe и кобальт Со — необходимые микроэлементы живых организмов.
Железо — биогенный элемент, содержится в тканях животных и растений. Общая масса железа в организме взрослого человека примерно 5г, что составляет 0,007%. Металлическое железо мало токсично, а соединения Fe(II), Fe(III) и Fe(VI) в больших количествах опасны для здоровья.

Наиболее важными с физиологической точки зрения являются железосодержащие белки: гемоглобин, миоглобин, цитохромы, пероксидазы, каталаза. Гемоглобин — главная составная часть эритроцитов. Общее содержание гемоглобина равно 700г, а кровь взрослых людей содержит в среднем около 14 – 15%. Обеспечивает внешнее дыхание, являясь переносчиком кислорода от легких к тканям. Миоглобин, цитохромы, каталаза обеспечивают клеточное дыхание. Например, в скелетной и сердечной мышце находится миоглобин. Он способен связывать до 14% общего количества кислорода в организме. Это его свойство играет важную роль в снабжение кислородом работающих мышц. Если при сокращение мышцы кровеносные капилляры её сжимаются и кровоток в некоторых участках мышцы прекращается, в течение некоторого времени сохраняется снабжение мышечных волокон кислородом.
Все эти белки состоят из собственно белковых частей и связанных с ними активных центров:

Активный центр представляет собой макроциклическое комплексное соединение — гем (от греч. — кровь). В качестве макроциклического лиганда выступает тетрадентантное соединение — порфирин. Донорные атомы азота расположены по углам квадрата, в центре которого расположен ион железа. В целом, комплекс имеет октаэдрическую конфигурацию. Пятая орбиталь через азот аминокислоты — гистидина используется для связи тема с белком. Шестая орбиталь свободна и может связывать различные низкомолекулярные лиганды R: O2, H2O2, CO, CN–.


Гемоглобин состоит из четырех белковых молекул (субъединиц), которые образуют единый макромолекулярный агрегат. Каждая субъединица по строению аналогична молекуле миоглобина. Таким образом, гемоглобин может одновременно связывать четыре молекулы О2 а миоглобин — одну.
В тканях имеется также несколько негемовых железосодержащих белковых комплексов. Это, например, ферменты — оксидазы, а также белки — накопители (депо) и переносчики железа. Избыток железа переносится с кровью белком — трансферрином и накапливается в виде белка — ферритина в различных тканях и органах, особенно в печени, селезенке, костном мозге. Трансферрин – класс железо связывающих молекул. Наиболее изученный – это трансферрин сыворотки – является транспортным белком, переносящим железо из обломков гемоглобина селезёнки и печени в костный мозг, где на специальных его участках вновь синтезируется гемоглобин. Весь сывороточный трансферрин, единовременно связывая только 4 мг железа, ежедневно переносит в костный мозг около 40мг железа – весьма существенное доказательство его эффективности как транспортного белка. Больные с генетически обусловленными нарушениями синтеза трансферрина страдают железодефицитной анемией, нарушениями иммунной системы и интоксикацией от избытка железа!
По химическому строению трансферрин – это гликопротеин с молекулярной массой около 80 000. Он состоит из одной полипептидной цепи, свёрнутой так, что она образует два компактных участка, каждый из которых способен связывать по одному иону железа (III). Правда, связывание железа возможно лишь при связывание аниона. В отсутствие подходящего аниона катион железа не присоединяется к трансфферину. В большинстве случаев в природе для этого используется карбонат, хотя активировать центр связывание металла способны и другие анионы, например оксалат, малонат, и цитрат.
Высокая устойчивость комплекса железа с трансферрином делает его отличным переносчиком, но зато и выдвигает проблему высвобождения железа из комплекса. Многие из хороших хелатирующих агентов малопригодны в качестве посредников при высвобождение железа. Наиболее эффективным из них оказался пирофосфат. Принимая во внимание существенную роль в связывание железа с транферрином, было бы логически предложить, что удаление аниона должно лежать в основе любого механизма высвобождение железа, однако никакой корреляции между способностью замещать карбонат в трансферриновом комплексе и их эффективностью как посредника в освобождение железа не найдено. В транспортной системе микробов отдача ионов железа переносчиком вызывается восстановлением их до Fe (II), но, как достоверно установлено, из трансферрина железо высвобождается в виде Fe (III). В органах млекопитающих железо в основном запасается в двух формах – ферритине и гемосидерине. Гемосидерин изучен не достаточно хорошо и, возможно, является продуктом распада ферритина. Ферритин (Мr 460000) в настоящее время охарактеризован довольно полно. Это водорастворимый белок, состоящий из 24 одинаковых субъединиц, которые составляют пустотелую сферическую оболочку. Во внутренней полости находится мицелярное ядро, содержание железа в котором примерно 57%. Мицела может содержать до 4500 атомов железа, если ферритин полностью насыщен железом (что не является обязательным). Белковую оболочку пронизывают шесть каналов, которые служат для приёма и отдачи железа.
Приём железа происходит при каталитическом окислении аппоферритином Fe (II) в Fe (III), а высвобождение – при восстановление Fe (II) восстановленными флавинами. В большинстве клеток синтез ферритина значительно ускоряется в присутствии железа; в клетках печени крыс синтез субъединиц проходит за 2 – 3 мин.
На основе законов химического равновесия нетрудно понять функционирование гемоглобина как переносчика кислорода от легких к тканям.
Гемоглобин без кислорода (дезоксигемоглобин) представляет собой слабую кислоту и его химическую формулу можно представить в виде ННb+ Карбонилгемоглобин представляет собой соединение гемоглобина с угарным газом. Это соединение примерно в 150 – 300 раз прочнее, чем соединение гемоглобина с кислородом. Поэтому примесь даже 0,1% угарного газа во вдыхаемом воздухе ведёт к тому, что 80% гемоглобина оказываются связанными с окисью углерода и не присоединяют кислород, что является опасным для жизни.
Присоединение кислорода сопровождается отщеплением протона и образуется оксигемоглобин НbO2. При этом имеет место равновесие:
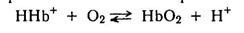
Оксигемоглобин несколько отличается по цвету от гемоглобина, поэтому артериальная кровь, содержащая оксигемоглобин, имеет ярко - алый цвет. Притом тем более яркий, чем полнее произошло её насыщение кислородом. Венозная кровь, содержащая большое количество восстановленного гемоглобина, имеет тёмно – вишнёвый цвет. При поступлении бедной кислородом венозной крови в легкие, где парциальное давление кислорода велико (до 20 кПа), его растворимость возрастает согласно закону Генри. Это приводит в соответствии с принципом Ле Шателье к смещению равновесия вправо и образованию оксигемоглобина. Дополнительное смещение равновесия вправо обусловлено тем, что в легких значение рН повышено (до 7,5). В результате в легких дезоксигемоглобин практически полностью (до 97%) насыщается кислородом и переходит в оксигемоглобин. В капиллярах, пронизывающих периферические ткани, парциальное давление кислорода снижается до 5 кПа, а значение рН снижается до 7,2. В результате равновесие смещается влево. В оттекающей с периферии крови гемоглобин насыщен кислородом лишь на 65%.
Таким образом, при циркуляции крови в организме равновесие ННb+ + О2 ó HbО2 + Н+ периодически сильно смещается (на 35%) то вправо, то влево.
Металлокомплексные свойства гемсодержащих белков проявляются при действии таких токсических веществ как СО (угарный газ) и MCN (цианиды — соли синильной кислоты).
Углерод моноксид СО — один из продуктов неполного сгорания топлива. Значительные количества этого газа выделяются при работе котельных, двигателей внутреннего сгорания, курении. При вдыхании СО с воздухом в легких параллельно с оксигемоглобином НbО2 образуется металлокомплексное соединение — карбонилгемоглобин НbСО. Константа устойчивости НbСО примерно в двести раз больше, чем у НbО2. Поэтому даже малые количества СО «перехватывают» значительную долю дезоксигемоглобина. В результате поступление кислорода к органам уменьшается. Появляются признаки гипоксии — кислородной недостаточности. В первую очередь страдают нервные ткани. Для детоксикации — устранения отравляющего действия углерод моноксида во многих случаях достаточно прекратить его поступление и усилить кислородную вентиляцию — вывести пострадавшего на «свежий» воздух. При этом опять работает принцип Ле Шателье — равновесие смещается в сторону образования оксигемоглобина.
При больших концентрациях углерод моноксид блокирует гемсодержащие белки клеточного дыхания и трудно избежать летального исхода.
Аналогичен механизм действия цианидов. Но их токсичность выше, чем для СО. Поступление в кровь даже очень небольших количеств этих веществ приводит к остановке дыхания и летальному исходу. Высокая токсичность цианидов объясняется высокой прочностью связи Fe — CN–, что обусловливает большую устойчивость цианидгемоглобина.
Кислородное дыхание приводит к образованию водород-пероксида Н2О2. Это вещество обладает высокой окислительной способностью. При его взаимодействии с биоорганическими соединениями клеток образуются радикалы — очень активные молекулярные частицы с ненасыщенной валентностью и инициируется пероксидное окисление. Под действием радикалов разрушаются важнейшие составные части клетки — мембраны и ДНК. В ходе биологической эволюции природа выработала особый белок – фермент каталазу, которая разрушает водородпероксид. Тем самым ограничивается избыточное накопление этого вещества и предотвращается разрушение клетки.
Действие каталазы (CatFe2+) может быть представлено в виде каталитического цикла из двух последовательных реакций:

В результате разрушаются две молекулы водородпероксида, а молекула биокатализатора CatFe2+ освобождается и может вступать в следующий каталитический цикл. Этот процесс очень быстрый. В течение секунды 1 молекула каталазы может осуществлять до 20 000 циклов.
При недостатке в организме железа может развиваться болезнь — железодефицитная анемия (малокровие). Возникает тканевая кислородная недостаточность, связанная с нехваткой железа для синтеза гемоглобина. В результате доставка кислорода к периферическим органам снижается, и, соответственно, понижается уровень клеточного дыхания, замедляется обмен веществ.
Введение в качестве лекарственных препаратов — железа (II) хлорида или железа (II) сульфата ослабляет остроту заболевания. Для этих же целей используется мелкодисперсный порошок металлического железа (железо восстановленное, до 1 г на прием), который легко растворяется в соляной кислоте желудочного сока. Поэтому действие этого препарата аналогично действию железа (II) хлорида. Однако более эффективны препараты, представляющие собой бионеорганические комплексы железа с сахарами (глюкоза), никотинамидом и другими органическими веществами (аскорбиновой кислотой). Примерами таких препаратов могут служить тотема, ферроплекс, сорбифер и др. Такие комплексы хорошо всасываются в кровь, с чем и связана их фармакологическая эффективность.
Интересно отметить, что с древних времен до настоящего времени для лечения железодефицитной анемии применяют так называемое «железное вино» — напиток, который получают путем настаивания виноградного вина на железных опилках. Очевидно, железо растворяется в вине (кислая среда) и образует комплексы с природными органическими веществами, которые содержатся в нем в больших количествах. Понятно, что механизм действия древнего напитка примерно тот же, что и у современных препаратов.
Кобальт. Как и железо, кобальт также является одним из важнейших биогенных элементов. Общая масса кобальта в организме взрослого человека примерно 1,2 мг, что составляет менее 2-10–6 %. Около 100 мг из этой массы находится в форме цианокобаламина (жирорастворимый витамин В12) и его аналогов. Это вещество, как и гем, представляет собой макроциклическое комплексной соединение:
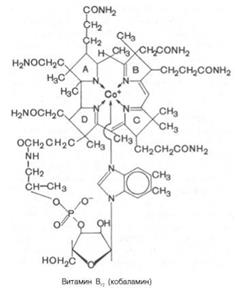

В качестве макроциклического лиганда выступает тетрадентатное соединение — порфин. R представляет собой сложный органический заместитель. В аналогах цианокобаламина вместо аниона СN– выступают различные органические заместители.
Наиболее важную роль витамин B12 играет в развитии и формировании эритроцитов (эритропоэз). Дефицит витамина В12 (поступление менее 3 мкг в сутки) приводит к тяжелому заболеванию — злокачественной анемии (малокровии).
Установлено, что аналоги цианокобаламина являются активаторами — кофакторами различных ферментов, участвующих в эритропоэзе. Недостаток кофакторов проявляется в дефиците гемоглобина и эритроцитов.
Растения и животные не могут синтезировать витамин B12. Его вырабатывают лишь некоторые виды бактерий. В желудочно-кишечном тракте человека такие бактерии имеются. Они синтезируют достаточное количество витамина В12. Злокачественная анемия связана с нарушением всасывания этого витамина в кровь. Поэтому прием таблеток мало эффективно. Инъекция витамина (100—200 мкг в течение 2 сут) в кровь существенно улучшает состояние больного при злокачественном малокровии.
Семейство платины
Не нашли, что искали? Воспользуйтесь поиском: