
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Задания для текущих и промежуточных контролей
1. В ходе газофазной реакции 2А + 3В →С за некоторый промежуток времени концентрация вещества А уменьшилась на 0,3 моль/л. Как и на сколько изменилась при этом концентрация вещества В?
Ответ: уменьшилась на 0,45 моль/л.
2. Чему равна скорость химической реакции, если концентрация одного из реагирующих веществ в начальный момент времени была равна 1,2 моль/л, а через 50 мин стала равной 0,3 моль/л?
Ответ: 0,018 моль/(л•мин).
3. Во сколько раз изменится скорость прямой реакции
2А + В 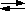 А2В,
А2В,
если концентрацию вещества А увеличить в 2 раза, а концентрацию вещества В уменьшить в 2 раза?
Ответ: увеличится в 2 раза.
4. Во сколько раз следует увеличить концентрацию вещества В2 в газофазной реакции
2А2 + В2 = 2А2В,
чтобы при уменьшении концентрации вещества А в 4 раза скорость реакции не изменилась?
Ответ: в 16 раз.
5. При взаимодействии оксида серы (IV) и кислорода концентрация кислорода уменьшилась на 0,25 моль/л в течение часа. Как и на сколько изменится при этом концентрация оксида серы (IV) и чему будет равна средняя скорость этой реакции по кислороду?
Ответ: уменьшится на 0,5 моль/л; 0,25 моль/(л•час).
6. Прямая реакция между веществами А и В протекает по уравнению
2А + В = С.
Начальные молярные концентрации веществ А и В равны 4 и 3 моль/л соответственно. Константа скорости реакции равна 0,1 л2/(моль2×с). Найдите скорость реакции в тот момент, когда прореагирует 50 % вещества А.
Ответ: 0,8 моль/(л•с).
7. Константа скорости прямой реакции
А + 2В = 3С
равна 0,6 л2/(моль2·с). Начальные молярные концентрации веществ А и В равны 2,0 и 2,5 моль/л соответственно. В результате реакции молярная концентрация вещества В оказалась равной 0,5 моль/л. Вычислите, какова молярная концентрация вещества А и скорость реакции.
Ответ: 1,0 моль/л; 0,15 моль/(л•с).
8. Прямая газофазная реакция идет по уравнению
4NH3 + 5O2 = 4NO + 6H2O.
Как изменится скорость прямой реакции, если увеличить давление в 2 раза.
Ответ: увеличится в 512 раз.
9. Как и во сколько раз изменится скорость образования аммиака из газообразных азота и водорода, если уменьшить вместимость реакционного сосуда в 5 раз?
Ответ: увеличится в 625 раз.
10. Константа скорости прямой газофазной реакции
А + 2В = С
при некоторой температуре равна 0,4 л2/(моль2×с), а начальные молярные концентрации веществ А и В составили соответственно 0,3 и 0,5 моль/л. Вычислите скорость этой реакции после того, как прореагирует 0,1 моль/л вещества А.
Ответ: 0,0072 моль/(л•с).
11. При некоторой температуре константа скорости прямой газофазной реакции
H2 + I2 = 2HI
составляет 0,16 л/(моль×мин), а начальные молярные концентрации водорода и йода соответственно равны 0,04 и 0,05 моль/л. Вычислите скорость реакции в момент времени, когда 
Ответ: 1,92.10-4 моль/(л•с).
12. Во сколько раз надо увеличить концентрацию водорода, чтобы увеличить в 216 раз скорость реакции синтеза аммиака из водорода и азота?
Ответ: в 6 раз.
13. Во сколько раз надо повысить давление при синтезе аммиака из газообразных водорода и азота, чтобы увеличить скорость этой реакции в 256 раз?
Ответ: в 4 раза.
14. Во сколько раз станет больше скорость прямой реакции по сравнению со скоростью обратной реакции в обратимой газофазной реакции
2NO + O2 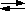 2NO2,
2NO2,
если увеличить давление в 5 раз?
Ответ: в 5 раз.
15. Как изменится скорость прямой реакции
СаО(к) + СО2(г) = СаСО3(к),
если увеличить концентрацию СО2 в 3 раза?
Ответ: увеличится в 3 раза.
16. Температурный коэффициент скорости реакции равен 2,1. На сколько градусов следует увеличить начальную температуру, чтобы сократить время протекания реакции в 103 раз. Ответ: на 93,1оС.
17. Насколько нужно повысить температуру, чтобы скорость реакции возросла в 90 раз? Температурный коэффициент равен 2,7. Ответ: на 45,3 градуса.
18. При повышении температуры с 20 до 60 °С скорость реакции возросла в 150 раз. Найдите температурный коэффициент реакции.
Ответ: 3,5.
19. При температуре 353 К реакция длится 20 с. Температурный коэффициент скорости данной реакции равен 2,5. Сколько времени будет проходить реакция при температуре 293 К?
Ответ: 4882,8 с.
20. Определите температурный коэффициент скорости реакции, если при понижении температуры на 45 °С реакция замедлилась в 25 раз.
Ответ: 2,045.
21. Константа скорости реакции, протекающей при температуре 273 К, равна 1,17 л/(моль×мин), а при температуре 298 К равна 6,56 л/(моль×мин). Найдите температурный коэффициент скорости реакции.
Ответ: 1,99.
22. Температурный коэффициент скорости реакции разложения йодистого водорода равен 2. При температуре 629 К константа скорости равна 8,9×10-5 л/(моль×с). Вычислите константу скорости данной реакции, протекающей при температуре 674 К.
Ответ: 2.10-3 л/(моль×с).
23. При температуре 0 °С реакция заканчивается за 64 мин. Сколько времени потребуется для завершения этой реакции при температуре 50 °С, если температурный коэффициент скорости реакции равен 2. Ответ: 2 мин.
24. Две реакции при температуре 20 °С протекают с одинаковой скоростью. Температурный коэффициент скорости первой реакции равен 2, а второй реакции равен 3. Как будут соотноситься скорости реакций, если первую проводить при температуре 60 °С, а вторую при температуре 40 °С?
Ответ: v1/v2=16/9.
25. Вычислите, при какой температуре реакция закончится за 45 мин, если при температуре 293 К на это требуется 3 часа. Температурный коэффициент скорости реакции равен 3,2.
Ответ: 304,92 K.
26. Во сколько раз уменьшится скорость реакции, протекающей в газовой фазе, если понизить температуру от 120 до 80 °С? Температурный коэффициент скорости реакции равен 3.
Ответ: в 81 раз.
27. При температуре 150 °С реакция заканчивается за 16 мин. Рассчитайте, через какое время закончится эта реакция, если ее проводить при температуре 200 °С. Температурный коэффициент скорости реакции равен 2,5.
Ответ: 9,83 с.
28. При температуре 393 К реакция заканчивается за 18 мин. Через какое время эта реакция закончится при температуре 453 К. Температурный коэффициент скорости реакции равен 3?
Ответ: 1,48 с.
29. Константа скорости реакции, протекающей при температуре 288 К, равна 2×10-2 с-1, а при температуре 325 К равна 0,38 с-1. Рассчитайте температурный коэффициент скорости этой реакции.
Ответ: 2,216.
30. Две реакции протекают при температуре 283 К с одинаковой скоростью. Температурный коэффициент скорости первой реакции равен 2,5, а второй – 3,0. Как будут соотноситься скорости реакций, если первую из них провести при температуре 350 К, а вторую – при температуре 330 К?
Ответ: v1/v2=464/175.
4.4. Лабораторная работа №2
Не нашли, что искали? Воспользуйтесь поиском: