
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Запрет Паули: в атоме не может быть двух электронов, имеющих одинаковый набор всех четырех квантовых чисел.
Принцип Паули означает, что на орбитали может находиться не более двух электронов. На s-подуровне (1 орбиталь) может находиться 2 электрона, на p-подуровне (3 орбитали) – 6 электронов, на d-подуровне (5 орбиталей) – 10 электронов, на f-подуровне (7 орбиталей) – 14 электронов. Максимальное число электронов на энергетическом уровне составляет 2n2, где n – главное квантовое число. Квантовые числа электронов и ёмкость первых трех энергетических уровней приведены в
табл. 5.1.
Таблица 5.1. Квантовые числа электронов и емкость энергетических уровней и подуровней
| Квантовые числа | Символ подуровня | Число электронов на подуровне | Число электронов на уровне | |||
| n | l | ml | ms | |||
| +1/2;-1/2 | 1s | |||||
| +1/2;-1/2 | 2s | |||||
| -1 | +1/2;-1/2 | 2p | ||||
| +1/2;-1/2 | ||||||
| +1/2;-1/2 | ||||||
| +1/2;-1/2 | 3s | |||||
| -1 | +1/2;-1/2 | 3p | ||||
| +1/2;-1/2 | ||||||
| +1/2;-1/2 | ||||||
| -2 | +1/2;-1/2 | 3d | ||||
| -1 | +1/2;-1/2 | |||||
| +1/2;-1/2 | ||||||
| +1/2;-1/2 | ||||||
| +1/2;-1/2 |
Принцип наименьшей энергии: электроны в первую очередь заполняют свободные орбитали с наименьшей энергией. Атомные орбитали располагаются в порядке увеличения их энергии следующим образом: 1s2 <2s2 <2p6<3s2<3p6<4s2<3d10< <4p6<5s2<4d10<5p6<6s2<4f14<5d10<6p6<7s2<5f14<6d10.
В многоэлектронных атомах энергия орбиталей определяется не только взаимодействием электронов с ядром, но и взаимодействием электронов между собой. Это проводит к появлению ряда нарушений вышеприведенной последовательности у отдельных d- и f-элементов. Явление носит название провал (проскок) электрона; проявляется в заполнении орбиталей с более высокой энергией при наличии незаполненных орбиталей с более низкой энергией и будет рассмотрено подробнее в следующем разделе.
Правило Клечковского: заполнение орбиталей происходит в порядке увеличения суммы квантовых чисел n+l; при постоянной сумме n+l заполнение происходит в порядке возрастания n. Применение правила Клечковского дает последовательность возрастания энергии орбиталей, приведенную ранее.
Правило Гунда: электроны заполняют орбитали вначале в виде холостых электронов с одинаковыми спинами, а затем в виде спаренных. Рассмотрим в качестве примера заполнение трех орбиталей р-подуровня. Орбиталь принято обозначать графически в виде квадратиков или прямоугольников, называемых квантовыми ячейками, а электроны обозначают стрелками, направление которых связывают со спином. Первые три электрона заполнят три р-орбитали по одному (холостые электроны) и с одинаковыми спинами (параллельные электроны) (рис. 5.2,а). Последующие электроны будут заполнять эти же орбитали, но будут иметь противоположные спины (рис. 5.2, б–г). Два электрона с противоположными спинами, занимающие одну орбиталь, называют спаренными или антипараллельными электронами. Неполностью заполненный подуровень или уровень называют ненасыщенным, а полностью заполненный – насыщенным.
| ↑ | ↑ | ↑ | ↑↓ | ↑ | ↑ | ↑↓ | ↑↓ | ↑ | ↑↓ | ↑↓ | ↑↓ |
а б в г
Рис. 5.2. Заполнение р-орбитали электронами: а – р3; б – р4; в – р5; г – р6 – конфигурации
Вопросы для самостоятельной подготовки
1. Сформулируйте принцип корпускулярно-волнового дуализма электрона. Запишите соответствующую формулу.
2.Сформулируйте принцип неопределенностиГейзенберга. Запишите соответствующую формулу.
3. Какой физический смысл имеет волновая функция и квадрат модуля волновой функции | ψ|2?
4. Какой физический смысл имеет икакие значения может принимать главное квантовое число?
5. Какой физический смысл имеет икакие значения может принимать орбитальное квантовое число?
6. Что означают понятия «энергетический уровень» и «энергетический подуровень»?
7. Какую форму имеют граничные поверхности s-, p- и d- орбиталей?
8. Какой физический смысл имеет икакие значения может принимать магнитное квантовое число?
9. Какой физический смысл имеет икакие значения может принимать спиновое квантовое число?
10. Сформулируйте принцип исключения Паули. Какое максимальное число электронов может находиться на s-, p-, d- и f-орбиталях соответственно?
11. Сформулируйте принцип наименьшей энергии. Запишите последовательность возрастания энергии атомных орбиталей.
12. Сформулируйте правило Гунда.
13. В чём различие между холостыми и спаренными электронами?
14. Какие значения может принимать магнитное квантовое число ml при орбитальном квантовом числе l = 1?
15. Какие из перечисленных обозначений атомных орбиталей не имеют физического смысла: 4f, 2d, 2s, 5p, 1p, 3f, 3d, 1s, 4s?
16. Чему равно максимально возможное число электронов на 4-м энергетическом уровне?
17. Сколько атомных орбиталей может быть на 3-м энергетическом уровне?
18. Чем отличается 2р-орбиталь от 3р-орбитали?
19. Сколько неспаренных электронов имеет атом азота?
20.Сколько электронов могут одновременно находиться на одной орбитали?
21. Чему равно число подуровней на внешнем энергетическом уровне?
22. Зависит ли максимальное число электронов, находящихся на данной атомной орбитали, от комбинации квантовых чисел?
23. Чему равно число энергетических подуровней для данного энергетического уровня?
24.Электрон находится на одной из 3d-орбиталей. Какое из следующих квантовых чисел недопустимо для такого электрона согласно уравнению Шредингера: а) n = 3; б) l = 1; в) ml = 1; г) ml = 2?
25. Одинаковое ли количество энергии поглощает атом при переходах 3p ® 3d и 3p ® 4s? Если неодинаковое, то при каком переходе больше?
5.3. Задания для текущих и промежуточных контролей
1. Какой физический смысл имеет волновая функция y и квадрат модуля волновой функции |y|2?
2. Объясните физический смысл понятия «атомная орбиталь» (АО).
3. Зависит ли максимальное число электронов, образующих данную атомную орбиталь, от комбинации квантовых чисел n, l, ml?
4. Каковы значения квантовых чисел n, l, ml для 3d -атомных орбиталей?
5. Какими значениями орбитального квантового числа характеризуется состояние электрона с минимальной и максимальной энергией на энергетическом уровне n = 3?
6. Чему равно число энергетических подуровней для данного энергетического уровня? Каким значением главного квантового числа характеризуется энергетический уровень, если он расщеплен на 4 подуровня?
7. Какие квантовые числа определяют размер, форму и ориентацию в пространстве электронного облака?
8. Что показывает величина 2n2?
9. Какими параметрами отличаются 2р- и 3р- атомные орбитали?
10. Какие из перечисленных обозначений АО не имеют физического смысла: 4f, 2d, 2s, 5p, 1p, 3f, 7p?
11. Запишите электронные формулы атомов элементов с зарядом ядра 15, 24, 30, 36.
12. Укажите значения квантовых чисел n и l для внешних электронов в атомах элементов с порядковым номером 11, 33, 37.
13. Запишите электронные формулы ионов Ca2+, Al3+, S2-.
14. Назовите элемент, у атома которого в основном состоянии конфигурация АО последнего и предпоследнего уровней изображается комбинацией символов 4s23d104  4
4  4
4 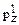 .
.
15. Предскажите электронный подуровень, на который поступит электрон, добавляемый к электронной структуре атомов Zn, Sr, Kr?
16. Какие элементы имеют электронную конфигурацию внешних уровней (n - 1)d5ns2?
17. Какие ионы имеют электронную конфигурацию, одинаковую с конфигурайией атома аргона?
18. Одинаковое ли количество энергии поглощает атом при следующих переходах электронов: 3р ® 3d и 4p ® 4d? Если не одинаковое, то при каком переходе больше? Почему?
19. Атомы каких элементов имеют конфигурацию внешнего энергетического уровня ns2p4: Ga, Sn, Te, Mn, Se, Cr? Аргументируйте ответ.
20. Чем различаются граничные поверхности 2s и 3s?
21. Расположите следующие подуровни в порядке возрастания их энергии: 2p, 4s, 3d, 4p, 5s, 4d.
22. Расположите следующие электроны в порядке возрастания их энергии связи с ядром: 3p, 1s, 3d, 2p, 3s, 5d.
23. Какие квантовые числа определяют энергию электронов?
24. В чём состоит различие понятий «орбита» и «орбиталь»?
25. Какое максимальное число электронов может находиться на N-уровне?
26. Как зависит максимальное число электронов, находящихся на данном энергетическом подуровне, от значения орбитального квантового числа?
27. Сколько неспаренных электронов имеет атом Cr в основном состоянии?
28. Чему равно число неспаренных р-электронов у атома серы в возбужденном состоянии?
29. Какие значения квантовых чисел соответствуют электронам 4р3- подуровня?
30. Расположите орбитали 1s, 3s и 5s в возрастания электронной плотности.
Не нашли, что искали? Воспользуйтесь поиском: