
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Жауабы: натрий сульфатының кристаллогидраты 30,5 грамм 1 страница
Алғы сөз
Қазіргі кезеңде елімізде қанатын жая бастаған, жаңа типті білім ордалары- Зияткерлік мектептердегі оқыту процесінің басты ерекшелігі оқушылардың дербестігін күшейтуге, білімдерін өздігінен толықтыру мәселесіне баса көңіл аудару болып табылады. Дербестіліктің дамуы жас зияткерлердің алған білімін іс жүзінде еркін қолдана білуінен байқалады. Ал дербестілікке қол жеткізу әрбір сабақта оқушылардың өзіндік жұмыстарын тиімді ұйымдастырумен, сол арқылы оқушылардың логикалық ойлау әркетін дамытумен тікелей байланысты. Оқушылардың өзіндік жұмысын ұйымдастыру кезінде оларға күрделілігі жоғары есептер беру өте маңызды. Өйткені белгілі бір «өзіндік құпиясы» бар, «қызық» есептер шығару – химия ғылымын өмірмен байланыстыратын тамаша әдіс. Есептер шығару арқылы баланың ойлау, есте сақтау, ғылым тілінде сөйлей алу қабілеттері дамиды, химиялық заңдар мен құбылыстарды түсінуі қалыптасып, дүниетанымы артады. Химия сабақтарында өзіндік жұмыс кезінде есептер шығару
барысында оқушылар:
• есептің шартын сауатты құра білу;
•есепке талдау жасай білу, зерттеу жүргізе білу;
•есептің типін анықтау;
•есептің шығару тәсілін таңдай білу, шығару жолының жоспарын жасау;
• масса мен көлем брліктерін Халықаралық жүйеге (СИ)- халықаралық жүйесіне келтіре білу;
• алынған жауапқа талдау жасай білу;
• қосымша әдебиетпен жұмыс жүргізе білу сияқты нақты біліктілікке ие болады.
Әрбір өзіндік жұмыста шәкірттер бойында белгілі бір икемділік, іскерлік дағды қалыптастыру сияқты мәселелерге ерекше назар аударылады. Оқушылардың білім мен білік, іс -әрекет дағдыларын тығыз қалыптастыра отырып, есте сақтау, тез ойлау, дұрыс жауап беру, өз пікірін айту, дәлелдей алу әрекеттері күшейіп, ой-өрісі шыңдала түседі.
Ұсынылып отырған «Қызықты химия есептері» жинағы түрлі деңгейдегі конкурстық және олимпиадалық «қызық», 8-9 сынып оқушыларына арналған күрделілігі жоғары есептерден және олардың шешу алгоритмінен құралады. Жинаққа химия сабақтарында оқушылардың өзіндік жұмыстары кезінде пайдаланған қызықты логикалық есептер енгізілген. Жинақта берілген алгоритмдерді жетік меңгеру химия-биология бағытындағы Назарбаев Зияткерлік мектептері оқушыларының логикалық ойлау дағдысын қалыптастырып, химиялық білім деңгейін жоғарылатады, материалды саналы игеру барысында біліктілік дағдыларының қалыптасуына жағдай жасайды деп көзделеді.
Сондай-ақ аталған есептер жинағын орта мектептерде олимпиадаға дайындық арнаулы курстарында, тереңдетілген бағдарлама бойынша оқитын сыныптарда өзіндік жұмыстарды ұйымдастыру барысында қолдануға болады.
1-есеп. Мынадай реактивтер берілген: H2SO4, NaOH, CaCO3, HCl, HBr және H2O, осы берілген реактивтерді пайдаланып, алюминий хлориді, натрий фториді, темір бромидінің ерітінділерін таза күйінде қалай алуға болады?
№ 1 есеп шешуі:
І. Темір (ІІІ) бромидінің бөлінуі:
I.
а) қоспа ерітіндісін сілті ерітіндісімен өңдейміз.
FeBr3 + 3NaOH = Fe(OH)3¯ + 3NaBr
AlCl3 + 4NaOH = NaAlO2 + 3NaCl + 2H2O
б) темір гидроксидін сүзіп аламыз.
в) темір гидроксидіне бромсутекпен әсер етеміз. Бастапқы бромидті аламыз:
Fe(OH)3 + 3HBr = FeBr3 + 3H2O
II. Алюминий хлориді бөлінеді:
а) бастапқы қоспаның ерітіндісін сілтімен өңдеген кезде алынған сүзіндіні (NaAlO2, NaCl, NaF), көмірқышқыл газы арқылы өңдейміз.
(CaCO3 + 2HCl = CaCl2 + H2O + CO2)
2NaAlO2 + CO2 + 3H2O = 2Al(OH)3¯ + Na2CO3
б) алюминий гидроксидін сүзіп аламыз. Алюминий гидроксидіне хлорсутекпен әсер еткенде бастапқы алюминий хлоридінің ерітіндісін аламыз:
Al(OH)3 + 3HCl = AlCl3 + 3H2O
III. Натрий фторидінің бөлінуі:
а) сүзіндіні (Na2CO3, NaF, NaCl, NaBr) хлорсутек қышқылымен өңдейміз:
Na2CO3 + 2HCl = 2NaCl + CO2 + H2O
б) кальций карбонаты мен хлорсутектен алынған затқа, кальций хлоридін қосамыз:
2NaF + CaCl2 = CaF2¯ + 2NaCl
в) кальций фторидін сүзіп алып және күкірт қышқылымен өңдейміз:
CaF2 + H2SO4 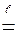 CaSO4¯ + 2HF
CaSO4¯ + 2HF
г) бөлінген фторсутекті сілті арқылы сіңіреміз және бастапқы натрий фторидін аламыз:
HF + NaOH = NaF + H2O
2-есеп. Белгісіз купоростың MeSO4×nH2O және сол купоросқа сәйкес келетін сусыз тұздың суда ерігіштігі 100 г суда 20 оС температурада 101,3 г және 38,4 г тең. Қандай заттар жөнінде сөз болып жатыр, белгісіз затты анықта.
№ 2 есеп шешуі:
Кейбір екі валентті ауыр металдардың (мыстың, никелдің, темірдің, мырыштың) кристаллогидраттары купоростар деп аталады. Кристалданған судың молекула саны n = 5 және 7 тең. Егер А – металдың атомдық массасы болса, онда А + 96 сусыз сульфаттың молекулалық массасы, ал С = 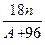 - кристалдық судың сусыз тұзға қатынасы, купоростың дәл сондай мөлшеріндегідей болады.
- кристалдық судың сусыз тұзға қатынасы, купоростың дәл сондай мөлшеріндегідей болады.
Кристаллогидрат пен сусыз тұздың суда ерігіштігін «С» арқылы өрнектейміз.
Кристаллогидтарттың ерігіштігі – sk болсын. Сусыз тұздың sb грамы Х г суда гидратталады деп есептесейтін болсақ. Х табудың екі тәсілі бар.
1 Тәсіл. Егер 100 г суда sk купоросты ерітетін болсақ, онда алынған ерітіндінің массасы 100 +sk (г) тең болады. Кристаллогидратты ерітуге жұмсалатын судың үлесі 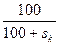 қаныққан ерітіндінің массасының бір бөлігіне тең. (sk – sb) – судың массасы, sb гидратталатын сусыз тұздың салмағы, (яғни Х), Х г суда ерітілген купоростың мөлшері қосылады. Онда Х =
қаныққан ерітіндінің массасының бір бөлігіне тең. (sk – sb) – судың массасы, sb гидратталатын сусыз тұздың салмағы, (яғни Х), Х г суда ерітілген купоростың мөлшері қосылады. Онда Х = 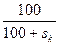 .(sk – sb) тең болады.
.(sk – sb) тең болады.
2 Тәсіл. 100 – Х (г) суда еріген кристаллогидрат Sb + X (г). Егер 100 г суда Sk г купорос еритін болса, онда 100 – Х г суда Sb + Х (г) купорос ериді деп есептеп, пропорция құрып есептейміз: 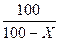 =
= 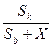 , осыдан, Х =
, осыдан, Х = 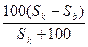 . Онда,
. Онда,
С = 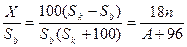 , осыдан
, осыдан
A = 
n = 5, A = 14,6 тең болады. Ондай металл жоқ. Егер n = 7, A = 58,8 болатын тең болатын болса, бұл никельдің атомдық массасы. Яғни NiSO4×7H2O және NiSO4 алынған деп есептейміз. (атомдық массасы жағынан жақын мәнге ие болатын кобальт болады деп формальді түрде есептеуге де, болады).
3-есеп. Калий перманганаты мен бром суы ерітінділері құйылған екі шыны ыдыс берілген.
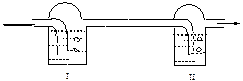 Ұзақ уақыт бойы шыны ыдыстарға химиялық таза кальций карбонатына немесе мырышқа концентрленген тұз қышқылымен әсер еткен кездегі бөлінген газ жіберілді, сол кезде екі шыны ыдыстағы сұйықтың түссізденгені байқалды. Калий перманганаты мен бром суы ерітінділері құйылған екі шыны ыдыс берілген.
Ұзақ уақыт бойы шыны ыдыстарға химиялық таза кальций карбонатына немесе мырышқа концентрленген тұз қышқылымен әсер еткен кездегі бөлінген газ жіберілді, сол кезде екі шыны ыдыстағы сұйықтың түссізденгені байқалды. Калий перманганаты мен бром суы ерітінділері құйылған екі шыны ыдыс берілген.
Зақ уақыт бойы шыны ыдыстарға химиялық таза кальций карбонатына немесе мырышқа концентрленген тұз қышқылымен әсер еткен кездегі бөлінген газ жіберілді, сол кезде екі шыны ыдыстағы сұйықтың түссізденгені байқалды. Егер екі шыны ыдыстың орындарын ауыстырып қоятын болсақ, сұйықтың түссізденуі біреуінде ғана байқалады. Егер құрғақ ауаны жіберетін болсақ, орнын ауытырмаса да, қандай ретпен орналасуына қарамастан, бір шыныдағы ерітіндінің түсі жойылады. Суреттелген құбылысты қалай түсіндіруге болады?
№3 есептің шешуі:
Егер бром суы және калий перманганатының ерітіндісі құйылған шыны арқылы құрғақ ауаны жіберетін болсақ, бром суы ертіндісінің түссізденгені байқалады, бұл оның жоғары ұшқыш қасиетіне байланысты болады. Кальций карбонаты немесе мырышқа хлорсутекпен әсер еткендегі реакция теңдеуі: бойынша
CaCO3 + 2HCl (конц.) = CaCl2 + CO2 + H2O
Zn + 2HCl = ZnCl2 + H2
Бөлініп жатқан көмірқышқыл газы немесе сутек газы бром суымен де, калий перманганатымен мүлдем әрекеттеспейді.
Газдарды бөліп алу үшін концентрленген хлорсутек қышқылын қолдану керек, себебі көмірқышқыл газы мен сутек реакциялық жүйе ортасынан хлорсутекті алып шығатынын екенін ескеруіміз қажет.
1 жағдай. 1-ыдыста калий перманганатының ерітіндісі бар, 2-ші ыдыста бром суы ерітіндісі бар. Реакция теңдеуі бойынша хлорлы сутек калий перманганатының түсін өзгертеді:
2KMnO4 + 16 HCl = 2MnCl2 + 5Cl2 + 8H2O + 2KCl
CO2 мен сутек газдары күштері әсерінен түзілген хлор екінші шыны ыдысқа үрленеді, бромның аз ерігіштігіне, ұшқыштығына байланысты бромның түсі өзгеріп, ерітіндіден бөлініп шығады.
ІІ жағдай. 1-шыны ыдыста бром суы бар, 2-ші шыны ыдыста калий перманганаты ерітіндісі бар.
Көмірқышқыл газы мен сутек газдарының қоспасы бром суы бар шыныға жеткізіліп тұрады, соның нәтижесінде хлорсутек суда ериді, ал көмір қышқыл газы мен сутек ерітіндіден бромды ығыстырып шығарып, нәтижесінде ерітінді түссізденеді. Екінші шыны ыдыста калий перманганаты ерітіндісімен көмірқышқыл газы және сутек газдары қоспасы бромның арасында химиялық өзгерістер жүрмейді. Ерітіндінің түсінің өзгерісі байқалмайды.
4-есеп. Барий хлоридінің 100 мл ерітіндісіне араластыра отырып 100 мл күміс нитратының және 150 мл күкірт қышқылының ерітіндісі бірге құйылды. Әрбір ерітіндінің концентрациясы 0,1 моль/л болды. Түзілген тұнбаның массасын анықтаңдар және ерітіндідегі еріген заттардың концентрациясын анықтаңдар.
№ 4 есептің шешуі:
Жүретін реакцияның теңдеуі:
BaCl2 + AgNO3 + H2SO4 =BaSO4¯ + AgCl¯ + HNO3 + HCl
Есептің шартында берілген мәні бойынша реакцияға қатысқан заттардың зат мөлшерін табамыз: BaCl2 – 0,01 моль, AgNO3 – 0,01 моль и H2SO4 – 0,015 моль. Күкірт қышқылының мөлшері 0,005 моль артық мөлшерде (реакция теңдеуі бойынша) екені анықталды.
Барий сульфаты мен күміс хлориді тұздары тұнбаға түседі, реакция теңдеу бойынша тұнбаға түскен тұздардың мөлшерін анықтауға болады: BaSO4 – 0,01 моль, а AgNO3 – 0,01 моль
Тұнбаның жалпы массасы:
233´0,01 + 143,5´0,01 = 2,33 + 1,435 = 3,765 (г)
Ерітіндіде 0,005 моль мөлшерде күкірт қышқылы, 0,01 моль азот қышқылы, 0,01 моль тұз қышқылы қалады. Түскен тұнбаның көлемін ескермей отырып, ерітіндінің көлемін табамыз.
100 мл + 100 мл + 150 мл = 350 мл
Тұз қышқылы, азот және күкірт қышқылдарының концентрациясын табамыз:
HCl концентрациясы = HNO3 концентрациясы= 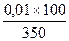 = 0,0286 моль/л,
= 0,0286 моль/л,
Ал күкірт қышқылының концентрациясы 2 есеге дейін аз болып, 0,0143 моль/л тең болады.
5-есеп. Кеңінен таралған сілтілік металдың тұзына концентрленген күкірт қышқылымен әсер еткенде бөлінген түссіз газды кеңінен таралған сілтілік жер металдың тұзының ерітіндісіне жіберілді. Сол кезде бөлінген Б газын күміс нитраты арқылы жібергенде тұнба түзілді. Тәжірибені жүргізуге қандай қышқылдардың тұздары және қандай сілтілік жер металдар қолданылды. Бақылаған құбылыстарды түсіндіріп, мүмкін болатын реакция теңдеуін жазыңдар.
№ 5есептің шешуі:
Сілтілік металдар тұздарына күкірт қышқылының концентрлі ерітіндісімен әсер еткенде газ бөлітіндері, карбонаттар, сульфидтер, хлоридтер, сульфиттер болуы мүмкін, мысалы:
2NaCl + H2SO4 = Na2SO4 + 2HCl
Na2SO3 + H2SO4 = Na2SO4 + SO2 + H2O
Na2CO3 + H2SO4 = Na2SO4 + CO2 + H2O
Na2S + H2SO4 = Na2SO4 + H2S
Есептің шартын қанағаттандыра алатын, суда еритін сілтілік металдар тұздары тек сульфидтер болып табылады, ал қалған суда ерігіш тұздары тек қана галогенсутектерді, күкіртті газды, көмір қышқыл газын бөлінбейді.
Күкіртті газ сульфидтермен бірге күкіртті түзеді. (H2S ығыстырып шығарып, SO2 әрекеттеседі) BaS + SO2 + H2O = BaSO3 + H2S
SO2 + 2H2S = 3S¯ + 2H2O
яғни қорғасын нитратымен тұнбаға түзілмейді. Көмірқышқыл газы сульфидтерден көмірқышқыл газын ығыстырып шығарады:
BaS + CO2 + H2O= BaCO3¯ + H2S
Осы бөлінген күкіртсутек газы қорғасын нитратымен қара түсті тұнба түзеді.
Pb(NO3)2 + H2S = PbS¯ + 2HNO3
Галогенсутектер сульфидтерден күкірт сутекті ығыстырып шығарады.
BaS + 2HCl = BaCl2 + H2S,
Қорғасын нитратымен қара түсті тұнба түзеді.
Pb(NO3)2 + H2S = PbS¯ + 2HNO3
Сондықтан мұндай сілтілік металл тұздары болып галогенидтер, карбонаттар болуы мүмкін, ал сілтілік жер металл тұздары – барий сульфиді болып табылады.
6-есеп. Белгісіз массасы 6 г металды оттегінде жаққан кезде, нәтижесінде массасы 10 г тең екі заттың қоспасы алынды. Бұл қоспа толығымен суда ериді. Мұндай ерітіндіні қайнатқан кезде, медицинада қолданылатын газ бөлінеді, ал қатты қалдықта тек қана бір ғана зат табылды. Қандай металл алынғанын анықта.
№ 6 есептің шешуі:
Жану өнімі толығымен суда ериді деп есептейтін болсақ, онда жанған кезде екі оттекті қосылыс түзіледі, былай ұсынуға болады, онда сілтілік металл (сілтілікжер металдардан тек қана Ba деп қана ұсынуға болады, себебі Ba(OH)2 суда аздап ери алады). Оттекті қосылыстар болып, тотықтар, пероксидтер, асқын пероксидтер (жанған кезде озонидтер түзілмейді. Суда барий пероксидінен басқа, тек тотықтар мен пероксидтер ғана ери алады. Яғни жану өнімі – тотықтар қоспасы болып табылады (оттектің эквиваленті 8 тең) және перекисте (оттектің эквиваленті 16). Егер перекисті оттегінің бір эквивалентіне «n» эквивалентті «тотықты оттек» сәйкес келетін болса, онда түзілген қоспадағы оттегінің орташа эквиваленттік мөлшері 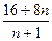 (г) тең болады. Жану өніміндегі оттектің мөлшері, оның орташа эквивалентті
(г) тең болады. Жану өніміндегі оттектің мөлшері, оның орташа эквивалентті 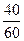 ×Эх, онда Эх – металдың эквиваленті (7, 23, 39, 84,5, 133, 137/2 мынаған тең). Теңдеу бойынша:
×Эх, онда Эх – металдың эквиваленті (7, 23, 39, 84,5, 133, 137/2 мынаған тең). Теңдеу бойынша:
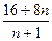 = 2/3Эх, бұдан n =
= 2/3Эх, бұдан n = 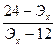 n > 0, онда 12 < Эх < 24, т.е. металл – натрий металы болып табылады, Эх = 23.
n > 0, онда 12 < Эх < 24, т.е. металл – натрий металы болып табылады, Эх = 23.
2Na + O2 = Na2O2
4Na + O2 = 2Na2O
Na2O + H2O = 2NaOH
Na2O2 + 2H2O = 2NaOH + H2O2
2H2O2 = 2H2O + O2
Буландырғаннан кейінгі қатты қалдық – NaOH.
7-есеп. Өзгерістер нәтижесінде тек қана екі зат: азот және су түзіле жүретін реакция теңдеуіне мысал келтіріңдер. Бұл реакциялардың ғылым мен техникадағы маңызын, қолданылатын жерлерін көрсетіңіздер. (бір типті реакция теңдеуін көрсетпеу керек).
№ 7есептің шешуі:
- Азот оксидтерінің сутекпен тотықсыздануы.
- Азоттың сутекті қосылыстары: аммиак, гидразин, гидразингидрат, аммоний азиді және т.б. оттекпен тотығуы (немесе озонмен). Азоттың сутекті қосылыстарының сутек пероксидімен тотығуы. Азоттың сутекті қосылыстарына азоттың оксидтерімен және азоттың оттекті қышқылдарымен әсер ету.
- Аммоний нитратының ыдырауы.
N2O + H2 реакциясы газкөлемдік анализде қолданылады.
Нитраттың ыдрауы – азоттың алынуы.
Азотқышқылды зауыттарда бөлінген NO газын басқа газдардан бөліп алу үшін NH3 пен жүргізілетін химиялық реакция қолданылады. Ракеталық техникада = гидразин мен оттектің, сутегінің асқын тотығы мен азот қышқылының реакциялары қолданылады.
8-есеп. А деген жай затты Б деген газда жаққан кезде В деген өнім түзіледі, ол өнім ылғал ауада “түтінденеді” және бірден булана алады. Егер ерітіндінің белгілі мөлшеріне аммноний карбонатын қосатын болсақ, ақ түсті Г тұнбасы пайда болады. Аммоний карбоанатын эквимолярлы мөлшерде натрий карбонатымен алмастыратын болсақ, құрамы дәл сондай, бірақ салмағы азырақ мөлшерде тұнба пайда болады. Егер Г тұнбасын қатты қыздыратын болсақ, қышқыл мен сілтіде еритін қасиетін жоғалтады. Жоғарыда айтылған процестерді түсіндір.
№ 8 есептің шешуі:
(А) алюминий, (Б) хлормен әрекеттесіп, (В) хлоридіне айналады. Алюминий хлоридіне карбонатпен әсер еткенде (Г) алюминий гидроксидінің тұнбасы түзіледі, қыздырған кезде оксидке айналады. Айналулар тізбегінде неліктен алюминий хлоридінің «түтінденіп» және алюминий хлоридінің бірден буланатынын, натрий карбонатымен әсер еткенде алюминий гидроксидінің массасы азаятынын және жаңадан дайындалған гидроксидпен салыстырғанда, қатты қыздырылған алюминий оксидінің химиялық активтілігі төмен екенін түсіндіру қажет.
9-есеп. Екі жай заттың қоспасын басқа екі жай заттың қоспасын әрекеттесті. Реакция нәтижесінде қалыпты жағдайда қатты күйде кездесетін, сумен өте қарқынды түрде әрекеттесетін бинарлы қосылыс болып табылатын бір ғана өнім түзіледі. Қыздырған бұл өнім екі бөлікке бөлінеді, бір бөлігі балқыма, бір бөлігі бірден буланатын затқа айналады, бірақ екі бөліктің де сапалық құрамы бірдей болады. Барлық бастапқы заттарды атаңдар. Реакция өнімін қыздырған кезде қандай өзгерістер болатынын түсіндіріңдер.
№ 9 есептің жауабы:
Реакция өнімі бойынша көрсетілген деректерге байланысты мынадай: бастапқы 4 затта екі элементтен тұрады қорытынды шығаруға болады. Осыған орай, аллотропиялық түрөзгерістер туралы, реакция өнімінің қасиетіне байланысты фосфор және оттек жайында сөз болып жатқаны туралы айтуға болады. Фосфордың (V) оксиді екі кристалдық модификациялық түр өзгерістер: бірі молекулалық кристалл торлы - ұшқыш, ал екіншісі атомдық кристалл торлы –ұшқыш емес түрінде кездеседі.
10-есеп. Төменде кейбір кристаллогидраттардың қаныққан ерітінділерімен және олардың тұздарының қаныққан ерітінділерінің 20 оС мм. сын.б. су буының қысымы берілген. Қалыпты жағдайда ашық ауада сақтақтайтын болсақ, берілген заттардың қайсысы балқып және қайсысы кристалдық суды жоғалтады? Концентрленген күкірт қышқылын эксикаторда қолдануды қалай түсіндіруге болады?
| Заттар | CaCl2×6H2O | NaCl | NH4NO3 | CuSO4×5H2O | Na2SO4×10H2O |
| Кристаллогидраттар.. | 2,5 | - | - | 5,1 | 15,3 |
| Қаныққан ерітінді | 7,5 | 10,5 | 16,6 |
№ 10 есептің жауабы:
Егер ауадағы су буы қысымынан (парциал қысымнан) кристаллогидраттағы немесе ерітіндідегі су буының қысымы жоғары болса, онда заттағы су буының азаюы байқалады. Ал қарама-қарсы жағдайда зат суды өз бойына сіңіреді. Соған байланысты, натрий сульфатының кристаллогидраты суды жоғалтады, ал кальций кристаллогидраты және аммоний нитраты – балқиды.
11-есеп. 100 мл құрамында хлоры және хлорсутегі бар сулы ерітіндіге жеке-жеке бөлікпен артық мөлшерде қатты натрий сульфитін қосты, сонан соң алынған ерітіндіні газ тәрізді заттар толығымен жойылғанша қыздырды. Оның мөлшері 300 мл бастапқы ерітіндімен әрекеттесуге жеткілікті болды. Алынған ерітіндідегі хлор мен хлорсутектің молдік қатынасын анықтаңдар.
№11 есептің шешуі:
Химиялық реакция теңдеуі:
Cl2 + Na2SO3 + H2O = Na2SO4 + 2HCl (1)
2HCl + Na2SO3 = 2NaCl + H2O + SO2 (II)
Ерітіндінің жаңа бөлігіне күкірттің диоксиді «қайтарылады»:
SO2 + Cl2 + 2H2O = H2SO4 + 2HCl (III)
(II) және (III) реакцияның теңдеуін салыстырамыз. Бастапқы ерітіндіде х моль хлор болсын деп есептейік. Ерітіндінің екінші бөлігінің көлемі үш еселенеді, ондағы хлордың мөлшері 3 есе көп – 3х. Онда күкірттің диоксидінің мөлшері де 3х моль, ал әрекеттесетін хлорсутектің мөлшері 6х моль болады. Бірақ реакция теңдеуіне байланысты (І) х хлорға қосымша 2х моль хлорсутектің мөлшері сәйкес келеді.
Соған байланысты, бастапқы ерітіндідегі х моль хлорға 6х –2х = 4х моль хлорсутек сәйкес келеді, сондықтан газдардың молярлық қатынасы – 1:4 тең болады.
(ІІ) реакция теңдеуі бойынша бөлінетін күкірттің диоксиді, қоспадағы хлормен әрекеттеседі:
SO2 + Cl2 + 2H2O = H2SO4 + 2HCl (IV)
Бірақ бұл, жалпы бөлінген күкірттің диоксидінің мөлшеріне, ешқандай әсер етпейді, (IV) реакция бойынша алынған қышқылдар, сульфиттердің артық мөлшерімен күкірттің диоксидінің мөлшері эквивалентті мөлшерде болады.
Не нашли, что искали? Воспользуйтесь поиском: