
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Жауабы: натрий сульфатының кристаллогидраты 30,5 грамм 3 страница
А, Б және В заттарын атаңдар, мынадай мәндер белгілі болса:
| Заттар | Массалық үлес бойынша элементтік құрамы (%) | ||
| мыс | фосфор | Азот | |
| А | 40.0 | 19,4 | 0 |
| Б | 32,8 | 15,9 | 7,2 |
А,Б және В заттарының түзілуіне байланысты тиісті реакция теңдеулерін келтіріңдер.
21есептің шешуі:
Есептің шартындағы сандық есептеулерге қарап, осы тұздарды құрап тұрған химиялық элементтердің молярлық қатынастарын анықтаймыз. Бастапқы зат 100 г деп есептеп, элементтердің процент бойынша массалық үлесін есептейміз.
А заты:
N(Cu): n(P) =  = 0,625: 0,625 = 1: 1.
= 0,625: 0,625 = 1: 1.
Мыс гидрофосфаты үшін CuHPO4 қатынас осылай жүзеге асады. Осы заттағы сутек пен оттектің массалық үлесінің жиынтық мәнін табамыз.
w(H + O) =  = 40,6 (%)
= 40,6 (%)
Сондықтан тұздың элемнттік жиынтық құрамы: 40,0 + 19,4 + 40,6 = 100% құрайды, онда заттың формуласы дұрыс анықталған. Б заты:
n(Cu): n(P): n(N) =  = 0,513: 0,514:0,513 = 1: 1: 1.
= 0,513: 0,514:0,513 = 1: 1: 1.
Мұндай қатынаста тек қана мыс-аммоний фосфатына ғана тән. Осы заттың құрамындағы оттектің және сутектің массалық үлесінің жиынтық мәнін есептейміз:
w(H + O) =  = 34,9 %.
= 34,9 %.
Тұздың элементтік құрамының жалпы жиынтық мөлшері:
32,8 + 15,9 + 34,9 = 90,9 % құрайды.
Осыдан тұнбаның құрамына 9,2 % кристалдық су кіреді деп айтуға болады. Судың молекула саны ол мынаны құрайды:
 = 1.
= 1.
Олай болса, Б- затының формуласы: Cu(NH4)PO4×H2O – мыс-аммоний фосфатының моногидраты.
Заттың түзілуі:
А: CuO + H3Po4 = Cu(H2PO4)2 + H2O; H3PO4 артық мөлшерде.
2NH3 + H3PO4 = (NH4)2HPO4; қышқылдың артық мөлшерінде бейтараптанады.
Cu(H2PO4)2 + 2NH3 = CuHPO4 + (NH4)2PO4.
Б: Осы аталған процесс жоғарыда көрсетілген схема бойынша жүреді, аммиактың қосымша мөлшері әрі қарай мыс тұзының түзілуіне әкеледі:
CuHPO4 + NH3 + H2O = Cu(NH4)PO4×H2O.
В: 2CuHPO4 = Cu2P2O7 + H2O
2Cu(NH4)PO4×H2O = Cu2P2O7 + 2NH3 + 2H2O; В заты – мыс пирофосфаты.
Осы жұмыста мыс микроэлементімен байытылған бағалы тыңайтқыш – аммофосты алу әдісі зерттелді.
22-есеп. Мырыштың екі түрлі тұздарының (А және Б) өлшенген салмақ үлгісін қақтаған кезде, (ол тұздардың құрамындағы мырыштың массасы бірдей), екі жағдайда да, қоңыр түсті газ бөлінді, бөлініп шыққан газдарды ыстық күйдіргіш натр ерітіндісі арқылы өткізді. Осы кезде ерітінділер түссіз болып, сілтінің жоғарғы жағында жануды қолдайтын түссіз газ жиналды. Газ буларын сіңіру нәтижесінде сілті ерітіндісінің салмағы қақталған тұзбен салыстырғанда 49±1 % массасының артқаны байқалады. Сілтілік ерітінділерді азот қышқылымен бейтараптаған соң, оған күміс нитраты қосылды. Екі жағдайда да сары түсті тұнба пайда болды. Егер А және Б ыдыраған кезде бөлінген қоңыр түсті газдарды бөлме температурасына дейін суытатын болсақ, онда олар қоюланып сұйыққа айналады. Қоспадағы тұзды әрі қарай мұз арқылы суыта беретін болсақ, А тұзы ыдыраған кезде түссіз зат, Б тұзы ыдыраған кезде – қоңыр түсті кристалдар түзіледі. А және Б заттарының формуласын анықтаңдар. Эксперимент нәтижесінде қандай процестер жүрді? (Реакция теңдеуін жазыңдар.) Күміс нитратын қосқан кезде қандай жағдайда тұнба көбірек түзілді? А және Б тұздарын қақтаған кезде түзілген қатты қалдық қай жерде қолданылады?
22есептің шешуі:
Белгісіз екі А және Б тұздарын қақтаған кезде келесі өнімдер түзіледі: ZnO – мырыш оксиді және жануды қолдайтын түссіз газ (О2 болуы мүмкін) түзіледі. Осыдан, бұл тұздар оттекті қышқыл қалдығынан түзілген деп болжауға болады. Қоңыр түске боялған заттар көп емес, мысалы, NO2, Br2. Егер NO2 газын суытатын болсақ, сұйықтық конденсацияланып одан әрі сұйықтық одан әрі түссіз кристалдар түзіп димерленеді, бұл заттар N2O3 бөгде затымен әлсіз боялуы мүмкін 2NO2 = N2O4
Бұл жағдайда А заты – мырыш нитраты.
2Zn(NO3)2  2ZnO + 4NO2 + O2
2ZnO + 4NO2 + O2
2NaOH + 2NO2 = NaNO2 + NaNO3 + H2O.
Бұл болжамды тексеретін болсақ: мырыш нитратының салыстырмалы молекулалық массасы = 189, ал NO2 салыстырмалы молекулалық массасы = 46.
Олай болса, 2´189 г нитрат – 100 % массада
Онда 4´46 г азоттың диоксиді – х % массада,
х = 48,7 %, есептің шартына сәйкес.
Егер Б тұзын ыдыратқан кезде бөлінген қоңыр түсті газдар буы бром болса, онда 2Zn(BrOx)2 = 2ZnO + Br2 + (2x-1)O2/
Қандай оттекті қышқыл қалдығынан түзілген бром тұзының қайсысы ыдырағанын анықтаймыз. Егер тұздың молекулалық массасы Х г болса, онда бром – 160 г, бұдан
х г тұз – 100 %
160 г брома – 40-50%
(егер 48 %, онда х = 333 г, егер 50 %, онда 320 г). Осыған орай, М(тұз) = 320 – 333. Бромның үш түрлі оттекті қышқылдары бар: HBrO, HBrO3, HBrO4, олардың молекулалық массалары сәйкесінше 257, 321, 353, болады. Есептің шартына тек мырыш броматы ғана сәйкес келеді.
2Zn(BrO3)2 = 2ZnO + 2Br2 + 5O2
әрі қарай
6NaOH + 3Br2 = 5NaBr + NaBrO3 + 3H2O.
Азоттың диоксиді мен бромды сілтімен әсер еткенде түзілген өнім күміс нитратымен әрекеттескенде сары түсті тұнбалар пайда болады:
AgNO3 + NaNO2 = AgNO2¯ + NaNO3
AgNO3 + NaBr = AgBr¯ + NaNO3
Мырыш нитратының бір молінен бір моль натрий нитраты түзілетіні, ал мырыш броматының бір молінен 5/3 = 1,7 моль натрий бромиді түзілетіні реакция теңдеуінен көрінеді.
Екінші жағдайда тұнбаның мөлшері көбірек түзіледі, себебі күміс нитриті бромидпен салыстырғанда анағұрлым суда ерігіш. Күміс нитраты жеткіліксіз жағдайда масса бойынша бромидтер көбірек бөлінеді, себебі оның молекулалық массасы жоғары болады.
23-есеп. Азоттың диоксиді және көміртектің монооксиді бар газ қоспасы аузы жабық ыдыста әрекеттесті. Егер химиялық реакция теңдеуі NO2 + CO = NO + CO2 осылай бимолекулалы механизм бойынша жүретіні белгілі болса, онда қоспа компоненттерінде қандай парциал қысымда бастапқы реакцияның жылдамдығы максимал мәнге ие болатынын анықта. Қандай парциал қысымда компоненттердің бастапқы жылдамдығы 10 рет өзгереді. Екі жағдайда да қоспаның жалпы қысымы мен температурасы бірдей болады.
23есептің шешуі:
NO2 + CO = NO + CO2.
 .
.  жағдайда жылдамдық максимал мәнге ие болады. Осыған байланысты
жағдайда жылдамдық максимал мәнге ие болады. Осыған байланысты  ,
,  , но
, но  .
.  ,
,  ;
;  . Соған байланысты
. Соған байланысты  жылдамдық максимал мәнге ие, онда
жылдамдық максимал мәнге ие, онда  ;
;  =
=  , немесе 2а –а2 =0,1, осыдан =
, немесе 2а –а2 =0,1, осыдан =  .
.
Теңдеуді шешеміз а1 = 0,052; а2 = 1,948.
PCO мөлшерін 19,231 рет азайту қажет, ал мөлшерін  1,948 ретке дейін көбейту қажет.
1,948 ретке дейін көбейту қажет.
Немесе PCO 1,948 ретке көбейді, а  мөлшерін 19,231 ретке азайтамыз.
мөлшерін 19,231 ретке азайтамыз.
24-есеп. Күміс цианидінің суспензиясында тепе –теңдік орнағаннан кейінгі жағдайда, таза суда 20 оС ерітіндідегі күміс катиондарының концентрациясы 2,52×10-4 моль×л -1 тең болады. Күміс цианидінің ерігіштік көбейтіндісі мәні ЕКAgCN =7,1×10-15 моль2×л-2. тең. Кд HCN = 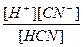 = 7,9×10-10 моль×л-1; KW =[H+][OH-] = 10-14 моль2×л-2.
= 7,9×10-10 моль×л-1; KW =[H+][OH-] = 10-14 моль2×л-2.
Ерітіндідегі күміс иондарының концентрациясы 2,52×10-4 моль×л-1 болатындай, мүмкін болатын жағдайдың барлығын көрсетіңіз. Есептің шартында берілген мәндердің барлығын пайдаланып, есептей отырып көрсетілген жағдайдың ішінен ең маңызды болып табылатынын көрсетіңдер. Күміс цианидінің ерігіштігін г/л есебінде есептеңдер. Есепті шығарған уақытта күміс цианидін толық диссициаланды деп есептеңдер.
24есептің шешуі:
AgCN  Ag+ + CN-, [Ag+] [CN-] = 7,1×10-15
Ag+ + CN-, [Ag+] [CN-] = 7,1×10-15
[CN-] =  = 2,82×10-11
= 2,82×10-11
Күміс иондарының концентрациясы цианид-иондармен салыстырғанда 7 ретке көп болып шықты. Цианид-аниондардың көп бөлігі компоненттер жүйесімен байланысқан, гидролиз процесі нәтижесінде жүзеге асады немесе күміс цианидімен комплекс түзу нәтижесінде жүзеге асады.
Гидролиз процесі: CN- + H2O  OH- + HCN.
OH- + HCN.
Осыған байланысты [CN-] << [Ag+], онда гидролиз процесі толығымен жүруі қажет.
Онда, [OH-] = [HCN]» [Ag+] = 2,52×10-10.
[H+] =  = 0,397×10-10.
= 0,397×10-10.
Осыдан КД(HCN) =  = 0,44×10-17, берілген мәнге КД(HCN) сәйкес келмейді.
= 0,44×10-17, берілген мәнге КД(HCN) сәйкес келмейді.
Цианид-аниондар ерітіндіде толығымен практика жүзінде комплекстік аниондар түрінде кездеседі деп қабылдаймыз:
AgCN + CN- = [Ag(CN)2]-.
Күміс цианидінің ерігіштігін анықтаймыз. Оның мәні 2×2,52×10-4 моль/л немесе 134×2×2,52×10-4 = 0,068 г/л.
25-есеп. Фосформолибденді комплекс ретінде фосфорды фотометриялық анықтау үшін, 100 мл құрамында 0,2300 г натрия гидрофосфаты бар стандартты ерітінді дайындалды. Төменде кестеде осы ерітіндінің көлемі берілген, сәйкесінше 25 мл суда сұйылтып, сонан соң олардың оптикалық тығыздықтары өлшенді.
| Стандартты ерітіндінің көлемі, мл | 0,10 | 0,25 | 0,50 | 0,75 | 1,00 |
| Оптикалық тығыздық (А) | 0,070 | 0,100 | 0,150 | 0,200 | 0,250 |
Массасы 0,0505 г жартылай өткізгіш фосфидтің өлшеп алынған салмақ үлгісін суда ерітілді, өңделген соң 1 л әлсіз боялған ерітінді алынды. Ерітіндіге 1,86 мл стандартты ерітіндіні қосу арқылы ерітіндінің бояуы қоюланды, сол кезде оптикалық тығыздық 0,214 тең болды. Оптикалық тығыздықты стандарттық ерітіндінің ерітіндінің көлеміне байланысты анықтаудың мүмкін болатын нұсқаларын атаңдар. Ұсынылған нұсқалардың ішінде зерттеліп отырған ерітіндінің ішінен фосфордың концентрациясын (г/мл) есебінде анықтаңдар.. Түстің қоюлану ерекшілігін түсіндіріңдер. Фосфидтің формуласын анықтаңдар. Фосформолибденді комплекстің формуласын жазыңдар.
25есептің шешуі: Стандартты ерітінді көлемінің оптикалық тығыздыққа байланысты теңдеуі
А = 0,2V + 0,05, немесе ең аз квадраттар әдісін қолдана отырып, графигін тұрғызып, мәнін анықтаймыз, А = 0,214 және сәйкес келеді V = 0,82 мл.
142 г Na2HPO4 - 31 г Р
0,230 г - х г х = 0,0502 г Р.
 фосфордың концентрациясы г/мл есебінде болады.
фосфордың концентрациясы г/мл есебінде болады.
Бояу түсінің қанығуы сызықтық аралықты анықтау үшін қажет. A = f(V).
m – анықталатын материалдағы фосфордың массасы.
 - анықталатын ерітіндідегі фосфордың концентрациясы г/мл есебінде.
- анықталатын ерітіндідегі фосфордың концентрациясы г/мл есебінде.
 ; m = 0,0156 г.
; m = 0,0156 г.
Жартылай өткізгіш фосфидтің формуласын табамыз:

 ; M = 23,12n; онда n = 3 M = 69,36 г/моль. Формуласы: GaP (галлия фосфиді).
; M = 23,12n; онда n = 3 M = 69,36 г/моль. Формуласы: GaP (галлия фосфиді).
Комплекс [PMo12O40]3-.
26-есеп. Магний, темірдің (ІІІ) және мыстың (ІІ) хлоридтерінің қоспасын суда ерітті.Осы ерітіндіге натрий сульфидінің артық мөлшерін қосқан кезде тұнба пайда болды, күкіртсутекті қосқандағы мөлшермен салыстырғанда массасы 2,51 есе көп тұнба түзілді. Егер ерітіндідегі темірдің (ІІІ) хлоридін теңдей мөлшерде темірдің (ІІ) хлоридімен алмастыратын болсақ, онда тұнбалардың массалар қатынасы 3,36 тең болады. Хлоридтер ерітіндісіне натрий сульфидімен және күкіртсутекпен әсер еткенде жүретін химиялық реакциялар теңдеулерін жазыңдар.
26есептің шешуі:
1. Хлоридтер қоспасына: магний (а моль), темір (ІІІ) (моль есебінде) және мыс (ІІ) (моль есебінде) күкіртсутекті қосқанда MgCl2 + H2S ¹
2FeCl3 + H2S = 2FeCl2 + S¯ + 2HCl
(тұнбаның массасы 32×  = 16в)
= 16в)
CuCl2 + H2S = CuS¯ + 2HCl
(тұнбаның массасы 96 – 96а – 96в).
Тұнбаның жалпы массасы: (96 – 96а – 80в) г.
2. Натрий сульфидін қосқан кезде:
MgCl2 + 2Na2S + 2H2O = Mg(OH)2¯ + H2S + 2NaCl
(тұнбаның массасы 58а)
2FeCl3 + 3Na2S = Fe2S3 + 6NaCl (2FeS +S болуы мүмкін)
(тұнбаның массасы = 104в)
CuCl2 + Na2S = CuS + 2NaCl
(тұнбаның массасы 96 – 96а – 96в).
Тұнбаның жалпы массасы: (96 + 8в – 38а) г.
3. Хлоридтер: магний (а моль), темір (ІІ) қоспасына күкіртсутекті қосқан кезде (162,5/127) = 1,28 және мыс (II) (1 – а – в) моль.
MgCl2 + H2S ¹
FeCl2 + H2S ¹
CuCl2 + H2S = CuS¯ + 2HCl (96 – 96а 96в массасы).
Жалпы массасы (96 – 96а – 96в) г.
4. Натрий сульфидін қосқан кезде:
MgCl2 + Na2S + 2H2O = Mg(OH)2¯ + H2S + 2NaCl (58а массасы).
FeCl2 + Na2S = FeS¯ + 2NaCl (1,28в´88 массасы).
CuCl2 + Na2S = CuS¯ + 2NaCl (96 – 96а – 96в массасы).
Жалпы масса: (96 – 38а + 16,6в) г.
 = 3,36 (II теңдеу).
= 3,36 (II теңдеу).
5. І және ІІ теңдеулер жүйесін шешеміз:
а = 0,2 моль; в = 0,5 моль; с = 0,3 моль
MgCl2 FeCl3 CuCl2
6. Қоспаның құрамын табамыз:
w(MgCl2) =  =
=  = 13,50%
= 13,50%
w(FeCl3) =  =
=  = 57,73%
= 57,73%
w(CuCl2) = 100 –13,50 – 57,73 = 28,77%
27-есеп. Мына ONO валенттік бұрыштар NO2+, NO2 и NO2- бөлшектерінде сәйкесінше
180, 134 и 115о мынаған тең. Мұндағы айырмашылықты түсіндір. Магниттік қасиеттердің маңызын және осы бөлшектердің димерлену қасиеттерінің мәнін түсіндір. Азот диоксидінің магниттік қасиетінің температураға әсері қандай?
27есептің шешуі:
| Бөлшек | Электрондық құрылысы | Құрылымдық формуласы | Азот атомының гибридтелуі |
| NO2+ | 
| 
| sp |
| NO2 | 
| 
| sp2 |

| |||
| NO2- | 
| 
| sp2 |

|
NO 2- анионында элемент атомдарының электрондық конфигурациясы жақын тұрған асыл газдардағыдай (8 электрон) ие болады, сонымен қатар азот пен оттек атомдары бөлінбеген электрон жұптарын түзеді. Электростатикалық тартылыс нәтижесінде аниондағы бұрыштың ONO минимал мәнге ие болады. Бейтарап бөлшекке NO2 көшу аралығында азот атомында жұптаспаған электрондар локализацияланады да, осы бөлшек парамагниттік қасиет көрсетіп және ONO бұрышы үлкен болады. NO2+ диамагнитті азот атомында жұптаспаған электрон жұптары болмайды, электростатикалық тебілу оттегінің электрон жұптарында бөлшекті сызықтық конфигурацияға әкеледі.
Парамагнитті бөлшектер оңай димерленіп N2O4 түзілуіне әкеледі. Қыздырған кезде тепе-теңдік солға ығысады да, жұптаспаған электрон сандары ұлғаяды.
28-есеп. Хром (ІІІ) хлоридінің сұйытылған ерітіндісінде H216O және H218O қоспасы бар, гексагидратты формасында тепе-теңдік жағдай орнайды:
Cr(H216O)63+ + H218O  Cr(H216O)5(H218O)3++ H216O
Cr(H216O)5(H218O)3++ H216O
Cr(H216O)5(H218O)3++ H218O  Cr(H216O)4(H218O)23+ + H216O және т.б.
Cr(H216O)4(H218O)23+ + H216O және т.б.
Осы берліген жағдайдың тепе- теңдігі алты түрлі константа бойынша сипатталады: K1, K2, K3, K4, K5 және K6.
K1 =  ; K2 =
; K2 =  және т.б.
және т.б.
Константалардың сандық мәндерін табыңыз.
28 есептің шешуі:
H216O және H218O реакциялық қабілеттілігі сумен алмасу реакциясында гидрокомплекстерде дәл сондай болады. Сондықтан тепе-теңдік константасы мәні
K= 
тек қана статистикалық факторлармен ғана анықталады. Жылдамдық константасы
Ктура реакция алмасу реакциясының H216O және H218O молекула санына пропорциональ молекула H216O берілген комплексте, ал жылдамдық константасы К кері реакция алмасу H218O осыдан H216O – молекула санына H218O комплексіндегі.
Алмасу процесіндегі бірінші молекула үшін H216O мен H218O Ктура реакция кері реакцияға пропорциональ болады, а К кері реакции 1 пропорциональ, онда К1 = 6/1 = 6 (суретке қара).

Ұқсас: K2 = 5/2; K3 = ¾; K5 = 2/5; K6 = 1/6. немесе жалпы түрде:
 =
=  , онда n = 1÷6.
, онда n = 1÷6.
29-есеп. Суда ерімейтін тұз басқа тұздың ерітіндісімен әрекеттесіп, реакция нәтижесінде тек қана ерігіш өнімдер түзілетіндей, әртүрлі химиялық реакциялардың типтеріне мысал келтіріңдер.
29есептің шешуі:
Ерімейтін тұздың еритін қосылыстарға айналуы келесі жағдайларда жүзеге асады:
1) Қышқыл –негіздік әрекеттесу.
а) Қышқыл тұздың орта немесе негіз тұздың тұнбасына әсер етуі:
MgCO3 + 2NaHSO4 = MgSO4 + Na2SO4 + H2O + CO2
Cu(OH)2×CuCO3 + 4NaHSO4 = 2CuSO4 + 2Na2SO4 + 3H2O + CO2
б) Гидролитті қышқыл ерітіндісінің орта немесе негіз тұзға әсер етуі.
MgCO3 + 2AlCl3 + H2O = MgCl2 + 2Al(OH)Cl2 + CO2
Реакция негіз тұзбен ғана жүреді. Алюминий хлоридінің ерітіндісі артық мөлшерде алу қажет, себебі негізгі алюминий хлоридінің тұнбасының түзілуін болдырмау қажет.
в) Еритін қос тұздардың түзілуі:
Не нашли, что искали? Воспользуйтесь поиском: