
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Доменный процесс производства чугуна
Доменный процесс производства чугуна составляют следующие стадии:
а) подготовка (обжиг) сульфидных и карбонатных руд – перевод в оксидную руду:

б) сжигание кокса при горячем дутье:

в) восстановление оксидной руды угарным газом СО последовательно (см. рубрики соответствующих оксидов):

г) науглероживание железа (до 6,67 % С) и расплавление чугуна:

В чугуне всегда в виде зерен присутствуют цементит Fe2C и графит.
Производство стали
Передел чугуна в сталь проводится в специальных печах (конвертерных, мартеновских, электрических), отличающихся способом обогрева; температура процесса 1700–2000 °C. Продувание воздуха, обогащенного кислородом, приводит к выгоранию из чугуна избыточного углерода, а также серы, фосфора и кремния в виде оксидов. При этом оксиды либо улавливаются в виде отходящих газов (СO2, SO2), либо связываются в легко отделяемый шлак – смесь Са3(РO4)2 и CaSiO3. Для получения специальных сталей в печь вводят легирующие добавки других металлов.
Получение чистого железа в промышленности – электролиз раствора солей железа, например:

(существуют и другие специальные методы, в том числе восстановление оксидов железа водородом).
Чистое железо применяется в производстве специальных сплавов, при изготовлении сердечников электромагнитов и трансформаторов, чугун – в производстве литья и стали, сталь – как конструкционный и инструментальный материалы, в том числе износо‑, жаро– и коррозионно‑стойкие.
Оксид железа(II) FeO. Амфотерный оксид с большим преобладанием основных свойств. Черный, имеет ионное строение Fe2+O2‑. При нагревании вначале разлагается, затем образуется вновь. Не образуется при сгорании железа на воздухе. Не реагирует с водой. Разлагается кислотами, сплавляется со щелочами. Медленно окисляется во влажном воздухе. Восстанавливается водородом, коксом. Участвует в доменном процессе выплавки чугуна. Применяется как компонент керамики и минеральных красок. Уравнения важнейших реакций:

Получение в лаборатории: термическое разложение соединений железа (II) без доступа воздуха:
Fe(OH)2 = FeO + H2O (150–200 °C)
FeCO3 = FeO + СO2 (490–550 °C)
Оксид дижелеза (III) – железа(II) (FeIIFe2III)O4. Двойной оксид. Черный, имеет ионное строение Fe2+(Fe3+)2(O2‑)4. Термически устойчив до высоких температур. Не реагирует с водой. Разлагается кислотами. Восстанавливается водородом, раскаленным железом. Участвует в доменном процессе производства чугуна. Применяется как компонент минеральных красок (железный сурик), керамики, цветного цемента. Продукт специального окисления поверхности стальных изделий (чернение, воронение). По составу отвечает коричневой ржавчине и темной окалине на железе. Применение брутто‑формулы Fe3O4 не рекомендуется. Уравнения важнейших реакций:

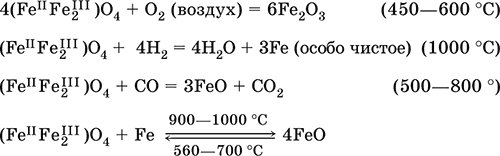
Получение: сгорание железа (см.) на воздухе.
В природе – оксидная руда железа магнетит.
Оксид железа(III) Fe2O3. Амфотерный оксид с преобладанием основных свойств. Красно‑коричневый, имеет ионное строение (Fe3+)2(O2‑)3. Термически устойчив до высоких температур. Не образуется при сгорании железа на воздухе. Не реагирует с водой, из раствора выпадает бурый аморфный гидрат Fe2O3 nН2O. Медленно реагирует с кислотами и щелочами. Восстанавливается монооксидом углерода, расплавленным железом. Сплавляется с оксидами других металлов и образует двойные оксиды – шпинели (технические продукты называются ферритами). Применяется как сырье при выплавке чугуна в доменном процессе, катализатор в производстве аммиака, компонент керамики, цветных цементов и минеральных красок, при термитной сварке стальных конструкций, как носитель звука и изображения на магнитных лентах, как полирующее средство для стали и стекла.
Уравнения важнейших реакций:

Получение в лаборатории – термическое разложение солей железа(III) на воздухе:
Fe2(SO4)3 = Fe2O3 + 3SO3 (500–700 °C)
4{Fe(NO3)3 9 H2O} = 2FeaO3 + 12NO2 + 3O2 + 36H2O (600–700 °C)
В природе – оксидные руды железа гематит Fe2O3 и лимонит Fe2O3 nН2O.
Гидроксид железа (II) Fe(OH)2. Амфотерный гидроксид с преобладанием основных свойств. Белый (иногда с зеленоватым оттенком), связи Fe – ОН преимущественно ковалентные. Термически неустойчив. Легко окисляется на воздухе, особенно во влажном состоянии (темнеет). Нерастворим в воде. Реагирует с разбавленными кислотами, концентрированными щелочами. Типичный восстановитель. Промежуточный продукт при ржавлении железа. Применяется в изготовлении активной массы железоникелевых аккумуляторов.
Уравнения важнейших реакций:

Получение: осаждение из раствора щелочами или гидратом аммиака в инертной атмосфере:
Fe2+ + 2OН(разб.) = Fe(OH)2↓
Fe2+ + 2(NH3 H2O) = Fe(OH)2 ↓ + 2NH4+
Метагидроксид железа FeO(OH). Амфотерный гидроксид с преобладанием основных свойств. Светло‑коричневый, связи Fe – О и Fe – ОН преимущественно ковалентные.
При нагревании разлагается без плавления. Нерастворим в воде. Осаждается из раствора в виде бурого аморфного полигидрата Fe2O3 nН2O, который при выдерживании под разбавленным щелочным раствором или при высушивании переходит в FeO(OH). Реагирует с кислотами, твердыми щелочами. Слабый окислитель и восстановитель. Спекается с Fe(OH)2. Промежуточный продукт при ржавлении железа. Применяется как основа желтых минеральных красок и эмалей, поглотитель отходящих газов, катализатор в органическом синтезе.
Соединение состава Fe(OH)3 не известно (не получено).
Уравнения важнейших реакций:

Получение: осаждение из раствора солей железа(III) гидрата Fe2O3 nН2O и его частичное обезвоживание (см. выше).
В природе – оксидная руда железа лимонит Fe2O3 nН2O и минерал гётит FeO(OH).
Феррат калия K2FeO4. Оксосоль. Красно‑фиолетовый, разлагается при сильном нагревании. Хорошо растворим в концентрированном растворе КОН, реагирует с кипящей водой, неустойчив в кислотной среде. Сильный окислитель. Качественная реакция – образование красного осадка феррата бария. Применяется в синтезе ферритов – промышленно важных двойных оксидов железа (III) и других металлов.
Уравнения важнейших реакций:

Получение: образуется при окислении соединений железа, например метагидроксида FeO(OH), бромной водой, а также при действии сильных окислителей (при спекании) на железо
Fe + 2KOH + 2KNO3 = K2FeO4 + 3KNO2 + H2O (420 °C)
и электролизе в растворе:

(феррат калия образуется на аноде).
Качественные реакции на ионы Fe2+ и Fe3+. Обнаружение ионов Fe2+ и Fe3+ в водном растворе проводят с помощью реактивов K3[Fe(CN)6] и K4[Fe(CN)6] соответственно; в обоих случаях выпадает синий продукт одинакового состава и строения, KFeIII[FeII(CN)6]. В лаборатории этот осадок называют берлинская лазурь, или турнбуллева синь:
Fe2+ + К+ + [Fe(CN)6]3‑ = KFeIII[FeII(CN)6]↓
Fe3+ + K+ + [Fe(CN)6]4‑ = KFeIII[FeII(CN)6]↓
Химические названия исходных реактивов и продукта реакций:
K3[Fe(CN)6] – гексацианоферрат (III) калия
K4[Fe(CN)6] – гексацианоферрат (II) калия
KFeIII[FeII(CN)6] – гексацианоферрат (II) железа(III) калия
Кроме того, хорошим реактивом на ионы Fe3+ является тиоцианат‑ион NCS‑, железо (III) соединяется с ним, и появляется ярко‑красная («кровавая») окраска:
Fe3+ + 6NCS– = [Fe(NCS)6]3‑
Этим реактивом (например, в виде соли KNCS) можно обнаружить даже следы железа (III) в водопроводной воде, если она проходит через железные трубы, покрытые изнутри ржавчиной.
Не нашли, что искали? Воспользуйтесь поиском: