
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Гипохлориты. Хлораты
Гипохлорит кальция Са(СlO)2. Соль хлорноватистой кислоты HClO. Белый, при нагревании разлагается без плавления. Хорошо растворим в холодной воде (образуется бесцветный раствор), гидролизуется по аниону. Реакционноспособный, полностью разлагается горячей водой, кислотами. Сильный окислитель. При стоянии раствор поглощает углекислый газ из воздуха. Является активной составной частью хлорной (белильной) извести – смеси неопределенного состава с СаCl2 и Са(ОН)2. Уравнения важнейших реакций:
Са(ClO)2 = СаCl2 + O2 (180 °C)
Са(ClO)2(т) + 4НCl (конц.) = СаCl2 + 2Cl2↑ + 2Н2O (80 °C)
Са(ClO)2 + Н2O + СO2 = СаСO3↓ + 2НClO (на холоду)
Са(ClO)2 + 2Н2O2 (разб.) = СаCl2 + 2Н2O + 2O2↑
Получение:
2Са(ОН)2 (суспензия) + 2Cl2(г) = Са(ClO)2 + СаCl2 + 2Н2O
Хлорат калия КСlO3. Соль хлорноватой кислоты НСlO3, наиболее известная соль кислородсодержащих кислот хлора. Техническое название – бертоллетова соль (по имени ее первооткрывателя К.‑Л. Бертолле, 1786). Белый, плавится без разложения, при дальнейшем нагревании разлагается. Хорошо растворим в воде (образуется бесцветный раствор), гидролиза нет. Разлагается концентрированными кислотами. Сильный окислитель при сплавлении.
Применяется как компонент взрывчатых и пиротехнических смесей, головок спичек, в лаборатории – твердый источник кислорода.
Уравнения важнейших реакций:
4КClO3 = ЗКClO4 + КCl (400 °C)
2КClO3 = 2КCl + 3O2 (150–300 °C, кат. MnO2)
КClO3(т) + 6НCl (конц.) = КCl + ЗCl2| + ЗН2O (50–80 °C)
ЗКClO3(т) + 2H2SO4 (конц., гор.) = 2ClO2| + КClO4 + Н2O + 2KHSO4
(диоксид хлора на свету взрывается: 2ClO2(г) = Cl2 + 2O2)
2КClO3 + Е2(изб.) = 2КЕO3 + Cl2↑ (в разб. HNO3, Е = Br, I)

Получение КClO3 в промышленности – электролиз горячего раствора КCl (продукт КClO3 выделяется на аноде):
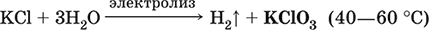
Бромиды. Иодиды
Бромид калия КBr. Бескислородная соль. Белый, негигроскопичный, плавится без разложения. Хорошо растворим в воде, гидролиза нет. Восстановитель (более слабый, чем KI).
Качественная реакция на ион Br – вытеснение брома из раствора КBr хлором и экстракция брома в органический растворитель, например СCl4 (в результате водный слой обесцвечивается, органический слой окрашивается в бурый цвет).
Применяется как компонент травителей при гравировке по металлам, составная часть фотоэмульсий, лекарственное средство.
Уравнения важнейших реакций:

Получение:
K2CO3 + 2HBr = 2 KBr + CO2↑ + H2O
Иодид калия KI. Бескислородная соль. Белый, негигроскопичный. При хранении на свету желтеет. Хорошо растворим в воде, гидролиза нет. Типичный восстановитель. Водный раствор KI хорошо растворяет I2 за счет комплексообразования.
Качественная реакция на ион I – вытеснение иода из раствора KI недостатком хлора и экстракция иода в органический растворитель, например СCl4 (в результате водный слой обесцвечивается, органический слой окрашивается в фиолетовый цвет).
Уравнения важнейших реакций:

Получение:
K2CO3 + 2HI = 2 KI + СO2↑ + Н2O
Халькогены
Кислород
Кислород – элемент 2‑го периода и VIA‑группы Периодической системы, порядковый номер 8, относится к халькогенам (но чаще рассматривается отдельно). Электронная формула атома [2He]2s22p4, характерные степени окисления чаще 0 и – II, реже – I и +II, состояние ОII считается устойчивым.
Шкала степеней окисления кислорода:

Кислород обладает высокой электроотрицательностью (3,50, второй элемент после фтора), проявляет типичные неметаллические свойства. Образует соединения со всеми элементами, кроме Не, Ne и Ar, входит в состав многочисленных оксидов, гидроксидов, солей кислородсодержащих кислот.
Природный кислород содержит изотоп 16O с примесью изотопов 17O и 18O. В химии большинство соединений природного кислорода рассматривается как изотопно‑чистые соединения кислорода‑16.
Кислород – самый распространенный элемент в земной коре (55 %) и природных водах, встречается в свободном и связанном виде. Жизненно важный элемент для всех организмов.
Кислород O2. Простое вещество. Состоит из неполярных молекул О2 (дикислород) с σπ‑связью O=O, устойчивая аллотропная форма существования элемента в свободном виде. Бесцветный газ, в жидком состоянии – светло‑голубой, в твердом – синий.
Составная часть воздуха: 20,94 % по объему, 23,13 % по массе. Из жидкого воздуха кислород выкипает после азота N2. Малорастворим в воде (31 мл/1 л Н2O при 20 °C), но несколько лучше, чем N2. При комнатной температуре обладает малой химической активностью из‑за прочности двойной связи в молекулах.
Кислород поддерживает горение многих веществ. Сильный окислитель при высоких температурах, реагирует с большинством металлов и неметаллов:


Кислород вызывает ржавление (медленное окисление) железа, уравнения реакций см. в 11.3. Особенно активен атомарный кислород О0 (активность выше, чем у озона O3), обычно получаемый непосредственно в зоне реакции при термическом разложении многих веществ.
Простейшая качественная реакция – яркое загорание тлеющей древесной лучинки в атмосфере кислорода.
Получение кислорода:
а) в промышленности – фракционная дистилляция жидкого воздуха, электролиз воды (уравнения реакций см. в разд. 12);
б) в лаборатории – нагревание легко разлагающихся кислородсодержащих веществ:
2HgO = 2Hg + O2 (450–500 °C)
2КMnO4 = К2MnO4 + MnO2 + O2 (200–240 °C)
2Na2O2 = 2Na2O + O2 (400–675 °C, вакуум)
2КClO3 = 2КCl + 3O2 (150–300 °C, кат. MnO2)
2KNO3 = 2KNO2 + O2 (400–520 °C)
Кислород является важнейшим продуктом основного химического производства. Применяется как реагент в химической технологии (обжиг сульфидных руд, синтез оксидов), металлургии (производство чугуна и стали) и газификации природного угля, при сварке и резке металлов; жидкий кислород – окислитель топлива в ракетной технике.
Убыль кислорода в атмосфере в результате процессов горения, гниения и дыхания возмещается растениями при фотосинтезе. При вдыхании человеком и животными воздуха в легкие кислород связывается с гемоглобином крови и переносится в клетки, где органические вещества (в первую очередь глюкоза) с его помощью окисляются и обеспечивают жизненную энергию организмов.
Озон O3. Простое вещество (трикислород), неустойчивая аллотропная форма существования элемента. Светло‑синий газ с характерным («озоновым») запахом, тяжелее воздуха. Молекула имеет строение незавершенного треугольника [: O(O)2] (sр2‑гибридизация, валентный угол 117°), содержит ковалентные σπ‑связи O=O. Разлагается под действием ультрафиолетового излучения, катализаторов и оксидов азота (разрушение озонового слоя атмосферы Земли). Устойчив в смеси с O2 (озонированный кислород). Малорастворим в воде (285 мл/1 л Н2O), но значительно лучше, чем O2. Сильный окислитель (более сильный, чем O2, но более слабый, чем атомарный кислород O0). Окисляет при комнатной температуре многие металлы и неметаллы до высоких степеней окисления. С надпероксидами щелочных металлов (К, Rb, Cs) образует оранжево‑красные озониды. Не реагирует с Au, Cu, Ni, Pt, Sn. Генерируется из кислорода O2 в специальном приборе – озонаторе.
Качественная реакция – выделение иода из раствора KI при комнатной температуре (O2 в реакцию не вступает). Уравнения важнейших реакций:

Получение: под действием электрического разряда в озонаторе:

Применяется для дезинфекции питьевой воды, при отбеливании тканей и минеральных масел, как реагент в
неорганическом и органическом синтезе. В атмосфере Земли озоновый слой (на высоте =25 км) защищает живой мир от воздействия космического ультрафиолетового излучения.
Атомарный кислород О0. Третья аллотропная форма кислорода. Более сильный окислитель по сравнению с O2 и O3. Образуется при распаде молекул O2 и O3 под действием ультрафиолетового излучения. Возникает при термическом разложении кислородсодержащих веществ (см. выше, получение O2); при отсутствии восстановителей тут же переходит снова в O2 и O3, в присутствии восстановителей окисляет их:
KNO3 = KNO2 + O0
О0 + С (графит) = СO2
Поэтому вещества, легко отщепляющие кислород при нагревании, проявляют сильные окислительные свойства.
Пероксид водорода Н2O2. Бинарное соединение. Молекула Н2O2 неплоская, имеет строение с σ‑связью О – О на ребре и связями Н – О на плоскостях двугранного угла. Степень окисления кислорода равна – I. Группа – О – О– называется пероксогруппой.
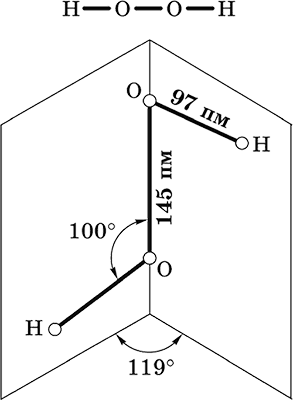
Бесцветная жидкость, вязкая, тяжелее воды, чувствительна к свету и примесям (стабилизатор Н3РO4). Разлагается со взрывом при слабом нагревании, на катализаторе – при комнатной температуре. Неограниченно смешивается с водой. Разбавленными щелочами нейтрализуется не полностью. Сильный окислитель, слабый восстановитель.
Пероксид водорода применяется как отбеливатель текстиля, бумаги, кож, жиров и минеральных масел, окислитель ракетного топлива, реагент в органическом синтезе, при осветлении картин старых мастеров (потемневший красочный слой из‑за перехода белил – гидроксокарбонатов свинца – в черный PbS осветляют переводом в белый PbSO4). В промышленности обычно используют взрывобезопасный 30 %‑ный раствор Н2O2 (пергидроль), в медицине – 3 %‑ный раствор.
Уравнения важнейших реакций:
2Н2O2 = 2Н2O + O2 (выше 150 °C или на кат. MnO2)
Н2O2 (разб.) + NaOH (разб.) = NaHO2 + Н2O
Н2O2 (конц.) + 2NaOH(т) = Na2O2↓ + 2H2O (0 °C)
Н2O2 (3 %) + 2H+ + 2I‑ = I2↓ + 2Н2O
5Н2O2 (30 %) + I2(т) = 2НIO3 + 4Н2O
Н2O2 (10 %) + SO32‑ = SO32‑ + H2O
4Н2O2 (30 %) + PbS (черн.) = 4H2O + PbSO4 (бел.)↓
3H2O2 + 2[Cr(OH)6]3‑ = 2CrO42‑ + 8H2O + 2OH‑
2Н2O2 (конц.) + Са(ClO)2 = СаCl2 + 2Н2O + 2O2↑
5H2O2 + 6H+ + 2MnO4‑ = 2Mn2+ + 5O2↑ + 8Н2O
Получение: в лаборатории вначале синтезируют пероксид бария ВаO2:
2ВаО + O2 (изб.) = 2ВаO2 (до 500 °C),
а затем его обрабатывают серной кислотой:
ВаO2 + H2SO4 = BaSO4↓ + Н2O2 (на холоду)
В промышленности (старый метод) – электролиз водного раствора H2SO4 или (NH4)2SO4 в специальных условиях; при этом кислота или соль не расходуются, а протекает электролиз воды с образованием на аноде Н2O2:

Современный промышленный способ (8O% мирового производства) – окисление сложного органического соединения 2‑этилантрагидрохинон кислородом воздуха на холоду.
Не нашли, что искали? Воспользуйтесь поиском: