
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Оксиды азота. Азотная кислота
Монооксид азота NO. Несолеобразующий оксид. Бесцветный газ. Радикал, содержит ковалентную σπ‑связь (N=O), в твердом состоянии димер N2O2 со связью N – N. Чрезвычайно термически устойчив. Чувствителен к кислороду воздуха (буреет). Мало растворим в воде и не реагирует с ней. Химически пассивен по отношению к кислотам и щелочам. При нагревании реагирует с металлами и неметаллами. Весьма реакционноспособна смесь NO и NO2 («нитрозные газы»). Промежуточный продукт в синтезе азотной кислоты.
Уравнения важнейших реакций:
2NO + O2 (изб.) = 2NO2 (20 °C)
2NO + С (графит) = N2 + СO2 (400–500 °C)
lONO + 4Р (красн.) = 5N2 + 2Р2O5 (150–200 °C)
2NO + 4Cu = N2 + 2Cu2O (500–600 °C)
Реакции смеси NO и NO2:
NO + NO2 + Н2O = 2HNO2(p)
NO + NO2 + 2KOH (разб.) = 2KNO2 + H2O
NO + NO2 + Na2CO3 = 2NaNO2 + CO2 (450–500 °C)
Получение: в промышленности – окисление аммиака (см.) кислородом на катализаторе, в лаборатории – взаимодействие разбавленной азотной кислоты с восстановителями:
8HNO3 (хол.) + 6Hg = 3Hg2(NO3)2 + 2 NO ↑ + 4Н2O
или восстановление нитритов:
2NaNO2 + 2H2SO4 (разб.) + 2NaI = 2 NO ↑ + I2↓ + 2H2O + 2Na2SO4
Диоксид азота NO2. Кислотный оксид, условно отвечает двум кислотам – HNO2 и HNO3 (кислота для NIV не существует). Бурый газ, при комнатной температуре мономер NO2, на холоду жидкий бесцветный димер N2O4 (тетраоксид диазота). Молекула NO2 – радикал со строением незавершенного треугольника [‑N(O)2] (sр2‑гибридизация) с ковалентными σ, π‑связями N=O. Молекула N2O4 содержит очень длинную связь N – N (175 пм), которая легко разрывается при температуре выше комнатной (в интервале 20,7–135,0 °C). Полностью реагирует с водой, щелочами. Очень сильный окислитель, вызывает коррозию металлов. Усиливает химическую активность NO (см.). Применяется для синтеза азотной кислоты и безводных нитратов, как окислитель ракетного топлива, очиститель нефти от серы и катализатор окисления органических соединений. Ядовит. Уравнения важнейших реакций:
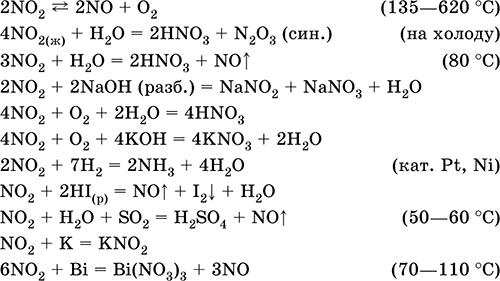
Получение: в промышленности – окисление NO (см.) кислородом воздуха, в лаборатории – взаимодействие концентрированной азотной кислоты с восстановителями:
6HNO3 (конц., гор.) + S = H2SO4 + 6NO2↑ + 2Н2O
5HNO3 (конц., гор.) + Р (красн.) = Н3РO4 + 5NO2↑ + Н2O
2HNO3 (конц., гор.) + SO2 = H2SO4 + 2NO2↑
Оксид диазота N2O. Бесцветный газ с приятным запахом («веселящий газ»), N=N=O, формальная степень окисления азота +I, плохо растворим в воде. Поддерживает горение графита и магния:
2N2O + С = СO2 + 2N2 (450 °C)
N2O + Mg = N2 + MgO (500 °C)
Получают термическим разложением нитрата аммония:
NH4NO3 = N2O + 2Н2O (195–245 °C)
Применяется в медицине как анестезирующее средство.
Триоксид диазота N2O3. При низких температурах – синяя жидкость, ON=NO2, формальная степень окисления азота +III. При 20 °C на 90 % разлагается на смесь бесцветного NO и бурого NO2 («нитрозные газы», промышленный дым – «лисий хвост»). N2O3 – кислотный оксид, на холоду с водой образует HNO2, при нагревании реагирует иначе:
3N2O3 + Н2O = 2HNO3 + 4NO↑
Со щелочами дает соли HNO2, например NaNO2.
Получают взаимодействием NO с O2 (4NO + 3O2 = 2N2O3) или с NO2 (NO + NO2 = N2O3) при сильном охлаждении. «Нитрозные газы» ядовиты и экологически опасны, действуют как катализаторы разрушения озонового слоя атмосферы.
Пентаоксид диазота N2O5. Бесцветное твердое вещество, O2N – О–NO2, степень окисления азота +V. При комнатной температуре за 10 ч разлагается на NO2 и O2. Реагирует с водой и щелочами как кислотный оксид:
N2O5 + Н2O = 2HNO3
N2O5 + 2NaOH = 2NaNO3 + H2O
Получают дегидратацией дымящей азотной кислоты:
2HNO3 + Р2O5 = N2O5 + 2НРO3
или окислением NO2 озоном при ‑78 °C:
2NO2 + O3 = N2O5 + O2
Азотная кислота HNO3. Оксокислота. Бесцветная жидкость. Молекула имеет искаженно‑треугольное строение [N(O)2(OH)] (sp2– гибридизация), содержит ковалентные σπ‑связи N=O и о‑связь N – ОН. Разлагается при стоянии на свету (желтеет). Хорошо растворяет оксиды азота (красно‑бурая «дымящая» кислота, плотность 1,56 г/мл). Неограниченно смешивается с водой, перегоняется при обычных условиях в виде азеотропной смеси (массовая доля кислоты 68,4 %, плотность 1,41 г/мл, температура кипения 120,7 °C), образует гидрат HNO3 Н2O (точнее, H3NO4 – ортоазотная кислота).
Сильная кислота в растворе, ион NO3‑ имеет строение правильного треугольника (sр2‑гибридизация). Нейтрализуется щелочами и гидратом аммиака. Реагирует с основными и амфотерными оксидами и гидроксидами, вытесняет слабые кислоты из их солей. Сильный окислитель в концентрированном растворе (за счет Nv). Образует смесь продуктов восстановления азота – от NIVO2 до N‑IIIН4+, в зависимости от концентрации кислоты и силы восстановителя в этой смеси преобладают разные продукты (условно для концентрированной кислоты указывают NO2, для разбавленной – NO, для очень разбавленной – NH4+).
Концентрированная кислота пассивирует Al, Be, Bi, Со, Cr, Fe, Ni и Pb, не реагирует с Au и Pt. Смесь HNO3 (конц.) и НCl (конц.) – «царская водка» – обладает еще более сильным окислительным действием: переводит в раствор золото и платину. Нитрующим началом HNO3 в ее реакциях с органическими веществами является ион NO2+ (нитроил).
В отличие от самой кислоты HNO3 ее соли – нитраты проявляют сильные окислительные свойства только при сплавлении за счет выделяющегося кислорода. При нагревании нитраты разлагаются по‑разному, в зависимости от положения металла в ряду напряжений:


Применяется азотная кислота для производства минеральных удобрений, взрывчатых веществ, нитратов металлов, органических нитропроизводных, искусственных волокон и пластмасс, красителей, лекарственных препаратов.
Уравнения важнейших реакций:

Получение: промышленный синтез состоит из следующих этапов:
N2 + Н2 → NH3 → NO → NO2 → HNO3 → HNO3,
а именно: производство аммиака (см.), каталитическое окисление аммиака (см.) до NO, перевод NO (см.) в NO2, поглощение смеси NO2 и O2 водой (см.).
Нитриты. Нитраты
Нитрит калия KNO2. Оксосоль. Белый, гигроскопичный. Плавится без разложения. Устойчив в сухом воздухе. Очень хорошо растворим в воде (образуется бесцветный раствор), гидролизуется по аниону. Типичный окислитель и восстановитель в кислотной среде, очень медленно реагирует в щелочной среде. Вступает в реакции ионного обмена. Качественные реакции на ион NO2‑ – обесцвечивание фиолетового раствора MnO4 и появление черного осадка при добавлении ионов I‑. Применяется в производстве красителей, как аналитический реагент на аминокислоты и иодиды, компонент фотографических реактивов.
Уравнения важнейших реакций:

Получение в промышленности – восстановлением калийной селитры в процессах:
KNO3 + Pb = KNO2 + PbO (350–400 °C)
KNO3 (конц.) + Pb (губка) + Н2O = KNO2 + Pb(OH)2↓
2KNO3 + СаО + SO2 = 2 KNO2 + CaSO4 (300 °C)
Нитрат калия KNO3. Оксосоль. Техническое название калийная, или индийская, селитра. Белый, плавится без разложения, при дальнейшем нагревании разлагается. Устойчив на воздухе. Хорошо растворим в воде (с высоким эндо ‑эффектом, Q = ‑36 кДж), гидролиза нет. Сильный окислитель при сплавлении (за счет выделения атомарного кислорода). В растворе восстанавливается только атомарным водородом (в кислотной среде до KNO2, в щелочной среде до NH3).
Применяется в производстве стекла, как консервант пищевых продуктов, компонент пиротехнических смесей и минеральных удобрений.
Уравнения важнейших реакций:

Получение: в промышленности
4KOH (гор.) + 4NO2 + O2 = 4 KNO3 + 2Н2O
и в лаборатории:
КCl + AgNO3 = KNO3 + AgCl↓
Фосфор
Фосфор – элемент 3‑го периода и VA‑группы Периодической системы, порядковый номер 15. Электронная формула атома [10Ne]3s23p3, устойчивая степень окисления в соединениях +V.
Шкала степеней окисления фосфора:

Электроотрицательность фосфора (2,32) значительно ниже, чем у типичных неметаллов, и немного выше, чем у водорода. Образует различные кислородсодержащие кислоты, соли и бинарные соединения, проявляет неметаллические (кислотные) свойства. Большинство фосфатов нерастворимы в воде.
В природе – тринадцатый по химической распространенности элемент (шестой среди неметаллов), встречается только в химически связанном виде. Жизненно важный элемент.
Недостаток фосфора в почве восполняется введением фосфорных удобрений – главным образом суперфосфатов.
Красный и белый фосфор Р. Известно несколько аллотропных форм фосфора в свободном виде, главные – это белый фосфор Р4 и красный фосфор Рn. В уравнениях реакций аллотропные формы представляют как Р (красн.) и Р (бел.).
Красный фосфор состоит из полимерных молекул Рn разной длины. Аморфный, при комнатной температуре медленно переходит в белый фосфор. При нагревании до 416 °C возгоняется (при охлаждении пара конденсируется белый фосфор). Нерастворим в органических растворителях. Химическая активность ниже, чем у белого фосфора. На воздухе загорается только при нагревании.
Применяется как реагент (более безопасный, чем белый фосфор) в неорганическом синтезе, наполнитель ламп накаливания, компонент намазки коробка при изготовлении спичек. Не ядовит.
Белый фосфор состоит из молекул Р4. Мягкий как воск (режется ножом). Плавится и кипит без разложения (tпл 44,14 °C, tкип 287,3 °C, ρ 1,82 г/см3). Окисляется на воздухе (зеленое свечение в темноте), при большой массе возможно самовоспламенение. В особых условиях переводится в красный фосфор. Хорошо растворим в бензоле, эфирах, сероуглероде. Не реагирует с водой, хранится под слоем воды. Чрезвычайно химически активен. Проявляет окислительно‑восстановительные свойства. Восстанавливает благородные металлы из растворов их солей.
Применяется в производстве Н3РO4 и красного фосфора, как реагент в органических синтезах, раскислитель сплавов, зажигательное средство. Горящий фосфор следует гасить песком (но не водой!). Чрезвычайно ядовит.
Уравнения важнейших реакций:

Получение в промышленности – восстановление фосфорита раскаленным коксом (песок добавляют для связывания кальция):
Са3(РO4)2 + 5С + 3SiO2 = 3CaSiO3 + 2 Р + 5СО (1000 °C)
Пар фосфора охлаждают и получают твердый белый фосфор.
Красный фосфор готовят из белого фосфора (см. выше), в зависимости от условий степень полимеризации n (Рn) может быть различной.
Фосфин РН3. Бинарное соединение, степень окисления фосфора равна – III. Бесцветный газ с неприятным запахом. Молекула имеет строение незавершенного тетраэдра [: Р(Н)3] (sр3‑гибридизация). Мало растворим в воде, не реагирует с ней (в отличие от NH3). Сильный восстановитель, сгорает на воздухе, окисляется в HNO3 (конц.). Присоединяет HI. Применяется для синтеза фосфорорганических соединений. Сильно ядовит.
Уравнения важнейших реакций:

Получение в лаборатории:
Са3Р2 + 6НCl (разб.) = ЗСаCl2 + 2 РН3 ↑
Оксид фосфора (V) Р2O5. Кислотный оксид. Белый, термически устойчивый. В твердом и газообразном состояниях димер Р4О10 со строением из четырех тетраэдров [O=Р(O)3], связанных по трем вершинам (Р – О–Р). При очень высоких температурах мономеризуется до Р2O5. Существует также стеклообразный полимер (Р2O5)n. Чрезвычайно гигроскопичен, энергично реагирует с водой, щелочами. Восстанавливается белым фосфором. Отнимает воду у кислородсодержащих кислот.
Применяется как весьма эффективный дегидратирующий агент для осушения твердых веществ, жидкостей и газовых смесей, реагент в производстве фосфатных стекол, катализатор полимеризации алкенов. Ядовит.
Уравнения важнейших реакций:

Получение: сжигание фосфора (см.) в избытке сухого воздуха.
Ортофосфорная кислота Н3РO4. Оксокислота. Белое вещество, гигроскопичное, конечный продукт взаимодействия Р2O5 с водой. Молекула имеет строение искаженного тетраэдра [Р(O)(OН)3] (sр3‑гибридизация), содержит ковалентные σ‑связи Р – ОН и σ, π‑связь Р=O. Плавится без разложения, при дальнейшем нагревании разлагается. Хорошо растворяется в воде (548 г/100 г Н2O). Слабая кислота в растворе, нейтрализуется щелочами, не полностью – гидратом аммиака. Реагирует с типичными металлами. Вступает в реакции ионного обмена.
Качественная реакция – выпадение желтого осадка ортофосфата серебра (I). Применяется в производстве минеральных удобрений, для осветления сахарозы, как катализатор в органическом синтезе, компонент антикоррозионных покрытий на чугуне и стали.
Уравнения важнейших реакций:

Получение в промышленности: кипячение фосфоритной руды в серной кислоте:
Са3(РO4)2 + 3H2SO4 (конц.) = 2 Н3РO4 + 3CaSO4↓
Ортофосфат натрия Na3PO4. Оксосоль. Белый, гигроскопичный. Плавится без разложения, термически устойчивый. Хорошо растворим в воде, гидролизуется по аниону, создает в растворе сильнощелочную среду. Реагируется в растворе с цинком и алюминием. Вступает в реакции ионного обмена.
Качественная реакция на ион РO43‑ – образование желтого осадка ортофосфата серебра (I).
Применяется для устранения «постоянной» жесткости пресной воды, как компонент моющих средств и фотопроявителей, реагент в синтезе каучука. Уравнения важнейших реакций:
Na3PO4 12Н2O = Na3PO4 + 12Н2O (200 °C, вакуум)
2РО43‑ (конц.) + 8Н2O + 2Al = 2[Al(ОН)4]‑ + 2НРО42‑ + ЗН2↑
2РО43‑ (конц.) + 4Н2O + Zn = [Zn(OH)4]2‑ + 2HPO42‑ + Н2↑
2РО43‑ (разб.) + ЗСа2+ = Са3(РO4)2↓
РО43‑ (разб.) + 3Ag+ = Ag3PO4↓ (желт.)↓
Получение: полная нейтрализация Н3РO4 (см.) гидроксидом натрия или по реакции:
2Н3РO4 + 3Na2CO3 = 2 Na3PO4 + 3CO2↑ + 3H2O
Гидроортофосфат натрия Na2HPO4. Кислая оксосоль. Белый, при умеренном нагревании разлагается без плавления. Хорошо растворим в воде, гидролизуется по аниону. Реагирует с Н3РO4 (конц.), нейтрализуется щелочами. Вступает в реакции ионного обмена.
Качественная реакция на ион НРО42‑ – образование желтого осадка ортофосфата серебра (I).
Применяется как эмульгатор при сгущении коровьего молока, компонент пищевых пастеризаторов и фотоотбеливателей.
Уравнения важнейших реакций:


Получение: неполная нейтрализация Н3РO4 гидроксидом натрия в разбавленном растворе:
2NaOH + Н3РO4 = Na2HPO4 + 2Н2O
Дигидроортофосфат натрия NaH2PO4. Кислая оксосоль. Белый, гигроскопичный. При умеренном нагревании разлагается без плавления. Хорошо растворим в воде, анион Н2РO4 подвергается обратимой диссоциации. Нейтрализуется щелочами. Вступает в реакции ионного обмена.
Качественная реакция на ион Н2РO4 – образование желтого осадка ортофосфата серебра(I).
Применяется в производстве стекла, для защиты стали и чугуна от коррозии, как умягчитель воды.
Уравнения важнейших реакций:

Получение: неполная нейтрализация Н3РO4 едким натром:
Н3РO4 (конц.) + NaOH (разб.) = NaH2PO4 + Н2O
Ортофосфат кальция Са3(РO4)2. Оксосоль. Белый, тугоплавкий, термически устойчивый. Нерастворим в воде. Разлагается концентрированными кислотами. Восстанавливается коксом при сплавлении. Основной компонент фосфоритных руд (апатиты и др.).
Применяется для получения фосфора, в производстве фосфорных удобрений (суперфосфаты), керамики и стекла, осажденный порошок – как компонент зубных паст и стабилизатор полимеров.
Уравнения важнейших реакций:
Са3(РO4)2 + 2H2SO4 (60 %) = Са(Н2РO4)2↓ + 2CaSO4↓ (до 50 °C)
Са3(РO4)2 + 4Н3РO4 (40 %) = ЗСа(Н2РO4)2↓ (примесь СаНРO4)
Са3(РO4)2 + 5С + 3SiO2 = 3CaSiO3 + 2Р + 5СО (1000 °C)
Смесь Са(Н2РO4)2 и CaSO4 называется простым суперфосфатом, Са(Н2РO4)2 с примесью СаНРO4 – двойным суперфосфатом, они легко усваиваются растениями при подкормке.
Наиболее ценные удобрения – аммофосы (содержат азот и фосфор), представляют собой смесь аммонийных кислых солей NH4H2PO4 и (NH4)2HPO4.
Хлорид фосфора (V) РCl5. Бинарное соединение. Белый, летучий, термически неустойчивый. Молекула имеет строение тригональной бипирамиды (sр3d‑гибридизация). В твердом состоянии димер Р2Cl10 с ионным строением РCl4+[РCl6]‑. «Дымит» во влажном воздухе. Весьма реакционноспособный, полностью гидролизуется водой, реагирует со щелочами. Восстанавливается белым фосфором. Применяется как хлорагент в органическом синтезе. Ядовит.
Уравнения важнейших реакций:

Получение: хлорирование фосфора.
7.5. Неметаллы IVA‑группы
Не нашли, что искали? Воспользуйтесь поиском: