
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Диоксид серы. Сульфиты
Диоксид серы SO2. Кислотный оксид. Бесцветный газ с резким запахом. Молекула имеет строение незавершенного треугольника [: S(O)2] (sр2‑гибридизация), содержит σ,π‑связи S=O. Легко сжижается, термически устойчивый. Хорошо растворим в воде (~40 л/1 л Н2O при 20 °C). Образует полигидрат, обладающий свойствами слабой кислоты, продукты диссоциации – ионы HSO3‑ и SO32‑. Ион HSO3‑ имеет две таутомерные формы – симметричную (некислотную) со строением тетраэдра [S(H)(O)3] (sр3‑гибридизация), которая преобладает в смеси, и несимметричную (кислотную) со строением незавершенного тетраэдра [: S(O)2(OH)] (sр3‑гибридизация). Ион SO32‑ также тетраэдрический [: S(O)3].
Реагирует со щелочами, гидратом аммиака. Типичный восстановитель, слабый окислитель.
Качественная реакция – обесцвечивание желто‑коричневой «йодной воды». Промежуточный продукт в производстве сульфитов и серной кислоты.
Применяется для отбеливания шерсти, шелка и соломы, консервирования и хранения фруктов, как дезинфицирующее средство, антиоксидант, хладагент. Ядовит.
Соединение состава H2SO3 (сернистая кислота) не известно (не существует).
Уравнения важнейших реакций:
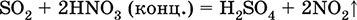

Растворение в воде и кислотные свойства:

Получение: в промышленности – сжигание серы в воздухе, обогащенном кислородом, и, в меньшей степени, обжиг сульфидных руд (SO2 – попутный газ при обжиге пирита):
S + O2 = SO2 (280–360 °C)
4FeS2 + 11O2 = 2Fe2O3 + 8 SO2 (800 °C, обжиг)
в лаборатории – вытеснение серной кислотой из сульфитов:
BaSO3(т) + H2SO4 (конц.) = BaSO4↓ + SO2↑ + Н2O
Сульфит натрия Na2SO3. Оксосоль. Белый. При нагревании на воздухе разлагается без плавления, плавится под избыточным давлением аргона. Во влажном состоянии и в растворе чувствителен к кислороду воздуха. Хорошо растворим в воде, гидролизуется по аниону. Разлагается кислотами. Типичный восстановитель.
Качественная реакция на ион SO32‑ – образование белого осадка сульфита бария, который переводится в раствор сильными кислотами (НCl, HNO3).
Применяется как реактив в аналитической химии, компонент фотографических растворов, нейтрализатор хлора при отбеливании тканей.
Уравнения важнейших реакций:

Получение:
Na2CO3 (конц.) + SO2 = Na2SO3 + CO2↑
Не нашли, что искали? Воспользуйтесь поиском: