
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
При воздействии на равновесную систему химическое равновесие смещается в сторону, противодействующую этому воздействию.
Рассмотрим подробнее влияние таких факторов, как температура, давление, концентрация, на смещение равновесия.
1. Температура. Повышение температуры смещает равновесие обратимой реакции в сторону процесса, идущего с поглощением теплоты (эндотермическое направление), а понижение температуры – в сторону процесса, идущего с выделением теплоты (экзотермическое направление).
Для экзотермической реакции:
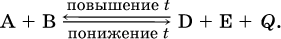
Для эндотермической реакции:
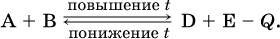
Значение Кс обязательно изменится при повышении и понижении температуры, так как значения констант скорости k прямой (→) и обратной (←) реакций по‑разному зависят от температуры, ведь это реакции между разными реагентами (соответственно А и В или D и Е). Следовательно, константа равновесия – функция температуры:
Kc = ƒ (t)
Примеры:
а) повышение температуры (нагревание):
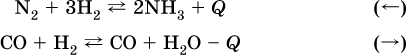
б) понижение температуры (охлаждение):
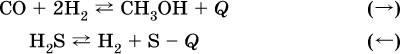
2. Давление. Изменение давления оказывает влияние только на те системы, где хотя бы одно вещество находится в газообразном состоянии (твердые и жидкие вещества не учитываются, так как их собственный объем весьма мал по сравнению с объемом газов и паров).
Увеличение давления в обратимой реакции смещает равновесие с сторону процесса, идущего с уменьшением количества газообразных веществ, т. е. с уменьшением объема, а уменьшение давления – в сторону увеличения количества газообразных веществ, т. е. с увеличением объема:
а)
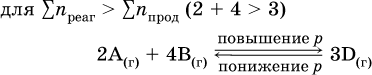
б)
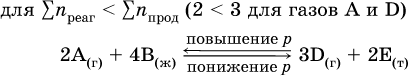
При Σnреаг = Σnпрод изменение не вызовет смещения равновесия.
Примеры гомогенных реакций:
а) увеличение давления (сжатие):

б) уменьшение давления (расширение):
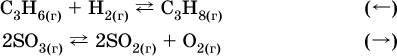
Примеры гетерогенных реакций (коэффициенты перед формулами конденсированных веществ не учитываются):
а) увеличение давления (сжатие):
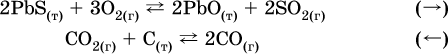
б) уменьшение давления (расширение):

В реакциях с равными количествами газообразных реагентов и продуктов (здесь 2 = 2 в обоих примерах):
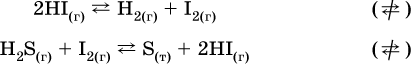
сдвиг равновесия наблюдаться не будет.
3. Концентрация. При увеличении концентрации одного из газообразных веществ (реагента или продукта), находящегося в равновесной системе, равновесие смещается в сторону расхода данного вещества. При уменьшении концентрации этого вещества равновесие смещается в сторону образования данного вещества. Изменение содержания твердых и жидких веществ не влияет на состояние равновесия.
Для некоторой реакции:
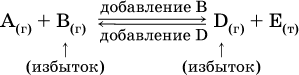
Смещение равновесия вправо можно было вызвать добавлением избытка реагента А (вместо В), а смещение влево возможно только избытком продукта D (другой продукт – твердое вещество).
Этот вывод следует непосредственно из равновесного закона действующих масс:
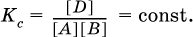
При добавлении в систему газа D равновесие сместится влево т. е. при протекании обратной реакции так увеличится содержание газов А и В, что соотношение концентраций останется постоянным и равным К с. Отметим еще раз, что добавление конденсированного вещества (здесь твердого Е) не повлияет на состояние равновесия (сдвиг равновесия добавлением Е невозможен).
Примеры:
а) при добавлении аммиака равновесие сместится вправо:
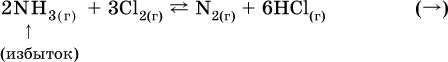
б) при добавлении водорода равновесие сместится влево:
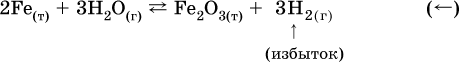
Не нашли, что искали? Воспользуйтесь поиском: