
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Константы диссоциации некоторых слабых кислот и оснований 7 страница
Задание VIII. По значению pH определить концентрацию предложенного раствора слабого электролита и выразить ее всеми возможными способами (табл.4.5).
Таблица 4.5
| Номер задачи | Электролит | рН | Плотность раствора, г/см3 | |||||
| NH4OH | 11,5 | 0,989 | ||||||
| CH3COOH | 3,23 | 1,0 | ||||||
| HCOOH | 1,9 | 1,01 | ||||||
| CH3COOH | 2,6 | 1,001 | ||||||
| NH4OH | 13,5 | 0,988 | ||||||
| C6H5NH3OH | 9,3 | 1,01 | ||||||
| N2H5OH | 10,1 | 1,01 | ||||||
| C6H5OH | 5,1 | 1,02 | ||||||
| HCOOH | 2,0 | 1,001 | ||||||
| CH3COOH | 2,9 | 1,0 | ||||||
| HNO2 | 1,9 | 1,0 | ||||||
| HCN | 4,6 | 1,01 | ||||||
| C6H5OH | 5,5 | 1,002 | ||||||
| NH4OH | 10,8 | 1,002 | ||||||
| HCN | 4,4 | 1,04 | ||||||
| HCOOH | 2,05 | 1,005 | ||||||
| CH3COOH | 2,8 | 1,0 | ||||||
| NH4OH | 11,1 | 1,0 | ||||||
| HCOOH | 2,9 | 1,007 | ||||||
| H2S | 3,9 | 1,0 | ||||||
| NH4OH | 12,0 | 1,0 | ||||||
| H3PO4 | 1,6 | 1,005 | ||||||
| C9H7NHOH | 8,7 | 1,0 | ||||||
| Лимонная кислота | 1,7 | 1,0 | ||||||
| Бензойная кислота | 2,5 | 1,003 | ||||||
| N2H5OH | 10,6 | 1,001 | ||||||
| HCOOH | 3,5 | 1,0 | ||||||
| C6H5NH3OH | 8,1 | 1,001 | ||||||
| CH3NH3OH | 12,2 | 1,001 | ||||||
Окончание табл.4.5
| Номер задачи | Электролит | рН | Плотность раствора, г/см3 | |||||
| C3H7NH3OH | 12,1 | 1,002 | ||||||
| C4H9NH3OH | 11,9 | 1,0 | ||||||
| C5H5NHOH | 10,92 | 1,0 | ||||||
| C2H5NH3OH | 8,6 | 1,0 | ||||||
| HNO2 | 1,2 | 1,01 | ||||||
| Винная кислота | 2,03 | 1,02 | ||||||
| H3BO3 | 4,7 | 1,03 | ||||||
| HBrO | 4,6 | 1,01 | ||||||
| H3BO3 | 4,9 | 1,04 | ||||||
| C6H5OH | 5,6 | 1,001 | ||||||
| H2S | 3,7 | 1,0 | ||||||
| H2CO3 | 3,1 | 1,05 | ||||||
| HF | 1,4 | 1,03 | ||||||
| C6H5NH2NH3OH | 11,0 | 1,003 | ||||||
| NH2OH×H2O | 10,4 | 1,0 | ||||||
| H3BO3 | 4,5 | 1,01 | ||||||
| (CH3)2NH2OH | 11,3 | 1,002 | ||||||
| (C2H5)2NH2OH | 11,7 | 1,0 | ||||||
| (CH3)3NHOH | 11,2 | 1,0 | ||||||
| C2H5ОNH3OH | 10,9 | 1,0 | ||||||
| CS(NH2)2×H2O | 9,0 | 1,01 | ||||||
Задание IX. Определить pH при смешивании двух растворов электролитов (табл.4.6).
Таблица 4.6
| Номер задачи | Первый раствор | Второй раствор | ||
| Объем, л | рН | Объем, л | рН | |
| 0,3 | 7,54 | 6,23 | 0,2 | |
| 0,75 | 4,07 | 5,16 | 0,55 | |
| 1,5 | 2,48 | 11,31 | 1,0 | |
| 2,5 | 3,16 | 10,05 | 1,5 | |
| 0,25 | 9,58 | 10,11 | 0,25 | |
| 1,0 | 2,56 | 11,03 | 1,5 |
Окончание табл.4.6
| Номер задачи | Первый раствор | Второй раствор | ||
| Объем, л | рН | Объем, л | рН | |
| 1,2 | 4,73 | 5,12 | 1,3 | |
| 3,0 | 1,25 | 12,32 | 2,0 | |
| 1,5 | 12,76 | 13,05 | 1,5 | |
| 0,5 | 8,76 | 6,15 | 1,0 | |
| 0,2 | 4,11 | 5,09 | 0,3 | |
| 2,2 | 3,35 | 8,65 | 0,3 | |
| 1,25 | 5,25 | 6,08 | 2,25 | |
| 0,35 | 10,17 | 4,47 | 0,16 | |
| 0,65 | 2,78 | 9,13 | 0,85 | |
| 0,25 | 6,82 | 5,47 | 0,75 | |
| 0,5 | 1,76 | 2,15 | 2,5 | |
| 1,5 | 11,83 | 10,48 | 2,5 | |
| 0,5 | 12,73 | 2,27 | 1,25 | |
| 15,0 | 2,17 | 4,21 | 3,0 | |
| 5,0 | 200,0 | |||
| 400,0 | ||||
| 5,0 | 2,31 | 4,18 | 7,2 | |
| 2,1 | 10,81 | 9,48 | 10,5 | |
| 10,1 | 9,2 | 11,2 | ||
| 0,2 | 5,48 | 6,08 | 12,8 | |
| 15,0 | 3,4 | 5,8 | 17,0 | |
| 12,3 | 13,8 | 10,54 | 20,5 | |
| 0,3 | 1,8 | 9,3 | 5,4 | |
| 1,44 | 7,5 | 8,5 | 14,4 |
Задание X. Решить задачи.
459. Смешали 10 л соляной кислоты концентрацией 3,65 г/л и 15 л гидроксида натрия концентрацией 2 г/л. Определить рН полученного раствора.
460. Найти объем раствора с рН = 3,8, если после добавления к нему 0,6 л раствора с рН = 10,5 образовался раствор с рН = 4,2.
461. Вычислить объем раствора 0,005 М соляной кислоты, если после добавления к нему 0,5 л раствора гидроксида бария концентрацией 0,003 моль/л получился раствор с рН = 4,03.
462. Определить объем раствора с рН = 10,13, если после добавления к нему 30 л раствора с рН = 9,76 образовался раствор с рН = 9,92.
463. Смешали 40 м3 раствора с рН = 6,7 и 2000 л раствора с рН = 8,3. Определить рН раствора после смешивания.
464. Определить объем раствора с рН = 13,4, если после добавления к нему 40000 л раствора с рН = 4,8 образовался раствор с рН = 8,5.
465. Определить рН раствора, если к 40 л раствора с рН = 6,7 добавили 2 л раствора с рН = 8,3.
466. Смешали 2 л серной кислоты концентрацией 0,01 моль/л и 3 л щелочи с рН = 12,5. Определить рН полученного раствора.
467. Определить объем раствора с рН = 11,3, если после добавления к нему 0,2 л раствора с рН = 2,9 и 0,5 л раствора с рН = 3,5 образовался раствор с рН = 4,1.
468. Определить объем раствора с рН = 2,14, если после добавления к нему 1,75 л раствора с рН = 11,85 образовался раствор с рН = 10,23.
469. Смешали 0,2 л 0,5 н. HCl и 0,3 л 0,3 М NaOH. Определить рН раствора после смешивания.
470. Определить объем раствора с рН = 10,13, если после добавления к нему 30 л раствора с рН = 9,76 образовался раствор с рН = 9,92.
471. Определить объем раствора с рН = 3,4, если после добавления к нему 9,8 л раствора с рН = 9,8 образовался раствор с рН = 4,6.
472. Определить рН раствора после смешивания 200 мл 0,5 н. раствора серной кислоты и 300 мл раствора едкого натра с концентрацией 0,3 моль/л.
473. Смешали 100 мл 0,015 н. раствора и 100 мл 0,09 н. раствора серной кислоты. Рассчитать рН полученного раствора.
474. Смешали 20 мл 0,5 н. раствора соляной кислоты и 10 мл 0,2 н. раствора гидроксида бария. Найти рН полученного раствора.
475. К 100 мл 0,2-процентного раствора едкого натра (NaOH) прибавили 200 мл 0,1-процентного раствора NaOH. Рассчитать рН полученного раствора.
476. К 200 мл 0,7 н. раствора серной кислоты прибавили 300 г воды. Рассчитать конечную концентрацию серной кислоты и определить рН раствора.
477. Смешали 54 мл 0,5-процентного раствора NaOH и 10 мл 0,2-процентного раствора NaOH. Рассчитать концентрацию полученного раствора и определить его рН.
478. Каким будет рН раствора, если к 500 мл 0,3-процентного раствора КОН прибавить 500 мл воды?
479. Смешали 4 мл серной кислоты концентрацией 0,46 % и 200 мл серной кислоты концентрацией 0,001 моль/л. Рассчитать рН полученного раствора.
480. Смешали 8 л раствора соляной кислоты концентрацией 0,04 моль/л и 11 л раствора ее же концентрацией 2 г/л. Рассчитать рН полученного раствора.
481. К раствору объемом 30 мл, содержащему 0,109 г серной кислоты в 100 мл раствора, прибавили 40 мл раствора NaOH, содержащего 0,098 г гидроксида натрия в 100 мл раствора. Найти концентрацию (в молях на литр) того вещества, которое останется в избытке, и вычислить рН полученного раствора.
482. Смешали 10 мл 0,12-процентного раствора HCl и 10 мл 0,076-процентного раствора HCl. Рассчитать процентную концентрацию и рН полученного раствора.
483. К 10 мл 6-процентного раствора соляной кислоты плотностью 1,03 г/см3 прибавили 10 мл 1-процентного раствора гидроксида бария плотностью 1,0 г/см3. Вычислить рН образующегося раствора.
Задание XI. Определить pH раствора после разведения (табл.4.7).
Таблица 4.7
| Номер задачи | pH исходного раствора | Разведение в n раз | Номер задачи | pH исходного раствора | Разведение в n раз | |||||||
| 10,32 | 11,47 | |||||||||||
| 2,17 | 1,55 | |||||||||||
| 1,51 | 13,44 | |||||||||||
| 2,42 | 12,7 | |||||||||||
| 3,25 | 3,45 | |||||||||||
Окончание табл.4.7
| Номер задачи | pH исходного раствора | Разведение в n раз | Номер задачи | pH исходного раствора | Разведение в n раз | |||||||
| 1,48 | 4,22 | |||||||||||
| 2,5 | 7,50 | |||||||||||
| 3,13 | 5,50 | |||||||||||
| 4,85 | 4,93 | |||||||||||
| 5,0 | 7,93 | |||||||||||
| 3,5 | 8,15 | |||||||||||
| 2,38 | 6,12 | |||||||||||
| 1,15 | 5,22 | |||||||||||
| 3,0 | 5,5 | |||||||||||
| 2,25 | 7,72 | |||||||||||
| 14,0 | 6,72 | |||||||||||
| 13,5 | 6,82 | |||||||||||
| 12,85 | 3,82 | |||||||||||
| 11,12 | 6,0 | |||||||||||
| 10,48 | 8,0 | |||||||||||
| 9,54 | 5,0 | |||||||||||
| 8,99 | 5,72 | |||||||||||
| 10,95 | 6,02 | |||||||||||
| 12,96 | 8,02 | |||||||||||
| 7,93 | 13,99 | |||||||||||
| 8,02 | 6,02 | |||||||||||
| 5,02 | 5,02 | |||||||||||
| 5,75 | 7,76 | |||||||||||
| 6,75 | 4,76 | |||||||||||
| 8,22 | 5,93 | |||||||||||
4.4. Гидролиз
Гидролиз – процесс разложения химических соединений в результате реакции с водой. Гидролиз соли – это реакция, обратная процессу образования соли путем нейтрализации кислоты основанием:
нейтрализация Þ
НА + МОН Û МА + Н2О.
кислота основание Ü гидролиз соль вода
Гидролизуются только соли, содержащие в своем составе ионы слабых электролитов: слабой кислоты или слабого основания.
Правила составления уравнений гидролиза следующие:
1. Записывают уравнение диссоциации соли.
2. Определяют ион слабого электролита, который может гидролизоваться. Ионов сильных кислот и оснований сравнительно немного, наиболее распространенные следует запомнить: анионы NO3-, SO42-, Cl-, Br-, I-, ClO4-, катионы Na+, K+ и других щелочных металлов, а также Ba2+ и Sr2+. Перечисленные ионы не гидролизуются! Все остальные ионы, за редким исключением, образуют слабые электролиты и гидролизуются.
3. Составляют ионное уравнение гидролиза по схеме:
ион слабого электролита + вода Û слабый электролит + ион,
оставшийся от молекулы воды.
4. Записывают молекулярное уравнение гидролиза, добавляя к ионам противоионы.
В зависимости от состава соли различают следующие типы гидролиза:
· Гидролиз соли, образованной сильным основанием и слабой кислотой. Гидролизуется анион слабой кислоты.
А- + Н2О Û НА + ОН-. (4.19)
В растворе появляются ионы ОН-, поэтому среда – щелочная, рН > 7.
Гидролиз соли, образованной слабым основанием и сильной кислотой. Гидролизуется катион слабого основания.
М+ + Н2О Û МОН + Н+.
В растворе появляются ионы Н+, поэтому среда кислая, рН < 7.
· Гидролиз соли, образованной двумя слабыми электролитами. Гидролиз протекает как по катиону, так и по аниону
М+ + А- + Н2О → МОН + НА.
Образующиеся слабые кислота и основание диссоциируют в разной степени, поэтому среда в растворе зависит от их относительной силы. Если кислота сильнее, то ее константа диссоциации больше и среда слабокислая. Если сильнее основание, то среда слабощелочная.
Количественные характеристики гидролиза - константа и степень гидролиза. В большинстве случаев константа гидролиза Kh не превышает 10–3 и гидролиз солей, образованных одним слабым электролитом, протекает в малой степени. Гидролиз многозарядных ионов в основном проходит по первой ступени. От значения константы гидролиза зависит рН раствора соли.
Степенью гидролиза b (аналогично степени диссоциации) называют отношение числа гидролизованных ионов к общему числу ионов слабого электролита в растворе.
Вычисление количественных характеристик гидролиза производится в зависимости от того, как образована соль:
· Соль образована одним слабым электролитом. Константа гидролиза
 , (4.20)
, (4.20)
где Kh 1 – константа гидролиза по первой ступени, Kw – ионное произведение воды, при 298 K KW = 10-14; Kdn – константа диссоциации продукта гидролиза.
Константы диссоциации гидроксокомплексов металлов называют ступенчатыми константами нестойкости, их значения даны в справочнике в таблице констант нестойкости гидроксокомплексов (прил.2).
Степень гидролиза связана с константой гидролиза уравнением
 ,
,
где С – концентрация гидролизующегося иона, моль/кг.
В растворах солей, гидролизующихся по аниону, среда щелочная (см. уравнение (67)) и расчет рН ведут по формуле:
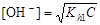 .
.
В растворах солей, гидролизующихся по катиону, среда кислая, согласно уравнению (4.19), и расчет рН ведут по формуле
 .
.
· Соль образована двумя слабыми электролитами. Константа гидролиза
 , (4.21)
, (4.21)
где K осн и K к – константы диссоциации основания и кислоты, образующих соль. Формула (4.21) служит для расчета константы гидролиза по табличным значениям констант диссоциации.
Степень гидролиза
 .
.
Отношение концентраций ионов Н+ и ОН- в растворе соли определяется относительной силой кислоты и основания:

где K к и K осн – константы диссоциации слабых кислоты и основания, которыми образована соль.
Таким образом, при 298 К (KW = 10-14):

или
 .
.
Константа и степень гидролиза у соли, образованной двумя слабыми электролитами, значительно выше, чем у солей, образованных одним слабым электролитом.
Пример 17. составить молекулярное и ионное уравнения гидролиза, указать характер среды для сульфата железа (II).
Решение. Напишем уравнение диссоциации соли: FeSO4 ® ® Fe2+ + SO42-. Определим сильный и слабый электролиты. Иону Fe2+ соответствует слабое основание Fe(OH)2, иону SO42- – сильная кислота H2SO4. Следовательно, гидролиз идет по катиону.
Составим ионное уравнение гидролиза (по первой ступени): Fe2+ + HOH ® FeOH+ + H+. В ходе гидролиза образуются ионы H+, среда кислая.
Составим молекулярное уравнение гидролиза и уравняем его как обычную реакцию обмена:
2 FeSO4 + 2H2O ® (FeOH)2SO4 + H2SO4.
Пример 18. составить молекулярное и ионное уравнения гидролиза, указать характер среды для карбоната калия.
Решение. Напишем уравнение диссоциации соли: K2CO3 ® ® K+ + CO32-. Определим сильный и слабый электролиты. Иону K+ соответствует сильное основание KOH, иону CO32- – слабая кислота H2CO3. Следовательно, гидролиз идет по аниону.
Составим ионное уравнение гидролиза (по первой ступени): CO32- + HOH ® HCO3- + OH-. В ходе гидролиза образуются ионы OH-, среда в растворе щелочная.
Составим молекулярное уравнение гидролиза и уравняем его как обычную реакцию обмена:
K2CO3 + H2O ® KHCO3 + KOH.
Пример 19. составить молекулярное и ионное уравнения гидролиза, указать характер среды для нитрита аммония.
Решение. Напишем уравнение диссоциации соли: NH4NO2 ® ® NH4+ + NO2-. Определим сильный и слабый электролит. Иону NH4+ соответствует слабое основание NH4OH, иону NO2- – слабая кислота HNO2. Следовательно, гидролиз идет как по катиону, так и по аниону. Составим ионное уравнение гидролиза:
NH4+ + NO2- + HOH ® NH4OH + HNO2.
Составим молекулярное уравнение гидролиза и уравняем его как обычную реакцию обмена:
NH4NO2 + H2O ® NH4OH + HNO2.
Пример 20. Вычислить рН раствора сульфата аммония концентрацией 0,1 моль/л.
Решение. Составим ионное уравнение гидролиза: NH4+ + H2O ® NH4OH + H+. Значение константы диссоциации гидроксида аммония Kd = 1,76×10-5. Вычислим константу гидролиза

Найдем концентрацию ионов аммония. Согласно уравнению диссоциации сульфата аммония (NH4)2SO4 ® 2 NH4+ + SO42-,

Вычислим концентрацию ионов

и
рН = –lg[H+] = –lg(1,066×10-5) = 4,97.
Пример 21. вычислить степень гидролиза карбоната натрия в растворе с рН = 12.
Решение. Составим ионное уравнение гидролиза: CO32- + + H2O ® HCO3- + OH-. Вторая константа диссоциации угольной кислоты Kd 2 = 4,69×10-11. Первая константа гидролиза по уравнению (4.20)

Из формулы  найдем концентрацию карбонат-иона
найдем концентрацию карбонат-иона
 ,
,
где [OH-] = 10-pOH = 10-(14-12) = 10-2.
Вычислим степень гидролиза

Задание XII. Составить молекулярные и ионные уравнения гидролиза, указать характер среды.
| 544. (NH4)2S 545. (NH4)2SO3 546. (NH4)3PO4 547. (ZnOH)2SO4 548. Al(NO3)3 549. Al2(SO4)3 550. Al2S3 551. AlCl3 552. Be(NO3)2 553. Ca(NO3)2 554. CdCl2 555. CH3COONH4 556. CoCl2 557. Cr(NO3)3 558. Cr2(SO4)3 559. CrCl3 560. Cs2SO4 561. CsF 562. CuSO4 563. Fe2(SO4)3 564. FeCl3 565. FeBr3 566. Ga(NO3)3 | 567. HCOOK 568. HCOONH4 569. K2SiO3 570. K2SO3 571. K3AsO4 572. KClO4 573. KCN 574. KH2AsO4 575. KHCO3 576. KMnO4 577. LiCN 578. MgCl2 579. MgSO4 580. MnCl2 581. Na2CO3 582. Na2HAsO4 583. Na2S 584. Na2SiO3 585. Na2WO4 586. Na3PO4 587. NaAlO2 588. NaCl 589. NaClO4 | 590. NaCN 591. NaH2PO4 592. NaHCO3 593. NaI 594. NaNO2 595. NH4Cl 596. NH4CNS 597. NH4HCO3 598. NH4NO2 599. NiSO4 600. Pb(CH3COO)2 601. Pb(NO3)2 602. PtCl4 603. Rb2S 604. Rb3PO4 605. Rb3SbO4 606. SbCl3 607. SnCl2 608. SnBr2 609. SnSO4 610. SrSO3 611. Zn(CH3COO)2 612. ZnBr2 |
Не нашли, что искали? Воспользуйтесь поиском: