
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Константы диссоциации некоторых слабых кислот и оснований 9 страница
Решение. Для образования осадка AgNO2 должно выполняться условие [Ag+][NO2-] ≥ L. Проверим, выполняется ли это условие. После смешивания равных объемов растворов AgNO3 и KNO2 общий объем раствора будет в 2 раза больше каждого из исходных, и концентрации AgNO3 и KNO2 соответственно уменьшатся в 2 раза, т.е. будут равны 0,01 моль/л. Так как [Ag+][NO2-] = 0,01×0,01 = 1×10-4 < L, осадок не образуется.
Задание XVI. Вычислить растворимость предложенного соединения в воде при температуре 25 °С и в присутствии электролита с одноименным ионом (табл.4.9).
Таблица 4.9
| Номер задачи | Твердая фаза | Электролит | Концентрация раствора |
| AgBr | AgNO3 | 0,01 г/л | |
| Ag2SO4 | K2SO4 | 0,01 М | |
| PbI2 | KI | 0,05 н. | |
| CaCO3 | Na2CO3 | 0,005 н. | |
| BaCrO4 | K2CrO4 | 0,001 М | |
| BaSO4 | BaCl2 | 0,001 г/л | |
| Ag2CO3 | Na2CO3 | 0,1 % | |
| CaSO4 | K2SO4 | 0,02 % | |
| PbBr2 | KBr | 0,003 н. | |
| PbSO4 | Pb(NO3)2 | 0,005 М. | |
| ZnS | ZnCl2 | 0,09 г/л | |
| Hg2SO4 | Na2SO4 | 0,001 г/л | |
| PbCO3 | K2CO3 | 0,02 г/л | |
| BaSO3 | Na2SO3 | 0,028 М | |
| AgIO3 | KIO3 | 0,009 н. | |
| CaHPO4 | CaCl2 | 0,01 г/л | |
| CuI | KI | 0,01 М | |
| TlI | NaI | 0,05 н. | |
| Hg2I2 | Hg2(NO3)2 | 0,005 н. | |
| Ag2S | AgNO3 | 0,001 М | |
| TlBr | NaBr | 0,001 г/л | |
| BaSO3 | Na2SO3 | 0,003 н. | |
| Ag3PO4 | AgNO3 | 0,005 М. | |
| PbS | Pb(NO3)2 | 0,09 г/л | |
| CaF2 | NaF | 0,001 г/л | |
| LaF3 | NaF | 0,02 г/л | |
| Ca3(PO4)2 | CaCl2 | 0,028 М | |
| Na3AlF6 | NaCl | 0,1 % | |
| AgBrO3 | NaBrO3 | 0,02 % | |
| AgCl | KCl | 0,003 н. | |
| AgI | KI | 0,005 М. | |
| Ag2CrO4 | AgNO3 | 0,09 г/л |
Окончание табл.4.9
| Номер задачи | Твердая фаза | Электролит | Концентрация раствора |
| CdCO3 | Cd(NO3)2 | 0,001 г/л | |
| CuCl | KCl | 0,02 г/л | |
| Hg2Br2 | KBr | 0,028 М | |
| Hg2Cl2 | KCl | 0,009 н. | |
| PbCl2 | KCl | 0,01 г/л | |
| TlCl | KCl | 0,01 М | |
| Ba3(AsO4)2 | Ba(NO3)2 | 0,05 н. | |
| Ba3(PO4)2 | K3PO4 | 0,005 н. | |
| Bi2(C2O4)3 | Bi(NO3)3 | 0,001 М | |
| Li3PO4 | K3PO4 | 0,001 г/л | |
| In4[Fe(CN)6]3 | K4[Fe(CN)6] | 0,003 н. | |
| Na2BeF4 | NaNO3 | 0,01 г/л | |
| K2SiF6 | KNO3 | 0,01 М | |
| Hg2CrO4 | Hg2(NO3)2 | 0,05 н. | |
| SnS | Na2S | 0,0005 н. | |
| Pb3(PO4)2 | K3PO4 | 0,01 М | |
| Tl2S | Na2S | 0,0005 н. | |
| Zn3(AsO4)2 | ZnSO4 | 0,009 н. |
Задание XVII. Определить рН гидратообразования предложенных солей (табл.4.10).
Таблица 4.10
| Номер задачи | Соль | Концентрация соли, моль/л | Номер задачи | Соль | Концентрация соли, моль/л |
| AlCl3 | 0,01 | CdCl2 | 0,15 | ||
| MgCl2 | 0,38 | Sb(NO3)3 | 0,002 | ||
| Be(NO3)2 | 0,52 | CoSO4 | 0,006 | ||
| MnSO4 | 0,062 | Sc(NO3)3 | 0,001 | ||
| Bi(NO3)3 | 0,046 | Cr2(SO4)3 | 0,059 | ||
| NiCl2 | 0,031 | SnCl2 | 0,012 | ||
| CaCl2 | 0,023 | Cu(NO3)2 | 0,038 | ||
| Pb(NO3)2 | 0,004 | SnCl4 | 0,003 |
Окончание табл.4.10
| Номер задачи | Соль | Концентрация соли, моль/л | Номер задачи | Соль | Концентрация соли, моль/л |
| FeSO4 | 0,064 | LaCl3 | 0,008 | ||
| Sr(NO3)2 | 0,055 | Y(NO3)3 | 0,0012 | ||
| FeCl3 | 0,26 | ZrOCl2 | 0,056 | ||
| Tl(NO3)3 | 0,001 | ZnSO4 | 0,022 |
Задание XVIII. Решить задачи.
798. Определить концентрацию карбоната натрия, необходимую для того, чтобы снизить растворимость карбоната серебра в 100 раз по сравнению с растворимостью в воде.
799. Чему равно произведение растворимости и растворимость иодида серебра в воде, если концентрация иодида серебра в 0,001 н. растворе иодида калия равна 1,5×10-13 моль/л?
800. Во сколько раз меньше растворимость гидроксида кобальта (II) в растворе с рН = 12, чем в растворе с рН = 10?
801. Какое из оснований – гидроксид железа (II) или гидроксид железа (III) – и во сколько раз лучше растворимо в щелочном растворе с рН = 9?
802. Определить растворимость и произведение растворимости гидроксида кальция, если его насыщенный раствор имеет рН = 12,4.
803. Определить растворимость гидроксида никеля в воде и в растворе с рН = 1.
804. При каком значении рН растворимость гидроксида кадмия снизится в 20 раз по сравнению с растворимостью в воде?
805. Определить произведение растворимости и растворимость в воде сульфата кальция, если концентрация соли в 0,2 н. растворе серной кислоты составляет 6×10-5 моль/л.
806. Определить произведение растворимости и растворимость сульфата свинца в воде, если концентрация соли в 0,004 н. растворе серной кислоты равна 8×10-6 моль/л.
807. Во сколько раз растворимость хлорида серебра в 0,001 н. растворе хлорида натрия меньше, чем в воде?
808. Определить растворимость гидроксида кобальта (II) в воде и в 0,1 н. растворе сульфата кобальта.
809. Определить растворимость гидроксида железа (II) в воде и в 0,05 М растворе сульфата железа (II).
810. Смешаны равные объемы 0,02 н. растворов хлорида кальция и сульфата натрия. Образуется ли при этом осадок сульфата кальция?
811. Во сколько раз растворимость оксалата кальция Са2С2О4 в 0,1 М растворе оксалата аммония меньше, чем в воде?
812. Во сколько раз уменьшится концентрация ионов серебра в насыщенном растворе хлорида серебра, если прибавить к нему столько соляной кислоты, чтобы концентрация хлорид-ионов в растворе стала равной 0,03 моль/л?
813. Растворимость бромида таллия (I) в воде 1,9×10-3 моль/л. Определить его произведение растворимости и растворимость в 0,1 н. растворе нитрата таллия (I).
814. Растворимость карбоната кальция в воде составляет 4,15×10-6 моль/л. Определить его произведение растворимости и растворимость в 0,001 М растворе карбоната натрия.
815. К 150 мл насыщенного раствора AgCl прибавили 10 мл раствора NaCl концентрацией 3 %. Сколько молей серебра останется в растворе?
816. К 125 мл насыщенного раствора PbSO4 прибавлено 5 мл раствора H2SO4 концентрацией 0,5 %. Сколько молей свинца останется в растворе?
817. К 20 мл Na2AsO4 прилили 30 мл 0,12 М раствора AgNO3. Какая масса мышьяка останется в растворе?
818. К 50 мл 0,02 М раствора CaCl2 прибавили 50 мл 0,03 М раствора сульфата калия. Какова остаточная концентрация сульфата кальция?
819. Выпадет ли осадок Mg(OH)2 при действии на 0,2 М раствор сульфата магния равным объемом 0,2 М раствора гидроксида аммония?
820. Насыщенный раствор CaSO4 смешали с равным объемом раствора, содержащего 0,0248 г (NH4)2C2O4 в 1 л. Произойдет ли образование осадка CaC2O4?
821. При какой концентрации ионов магния начнется выпадение осадка Mg(OH)2 из раствора, имеющего рН = 8,7?
822. При какой концентрации хромат-ионов начнется выпадение осадка PbCrO4 из 0,1 М раствора нитрата свинца (II)?
823. Будет ли осаждаться SrSO4 при добавлении 5 мл насыщенного раствора сульфата кальция к 20 мл раствора, содержащего 0,5 экв кальция?
824. В 200 мл раствора содержится по 0,02 экв хлорида и оксалата натрия. К раствору добавляют нитрат серебра. Какова будет остаточная концентрация хлорид-ионов и когда начнется осаждение Ag2C2O4?
825. Какое вещество начнет осаждаться первым при постепенном приливании нитрата серебра к раствору, в 1 л которого содержится 0,01 моль KCl и 0,1 моль K2CrO4?
826. В 100 мл раствора содержится 0,01 экв. ионов Ba2+ и Sr2+. Сколько молей K2CrO4 следует ввести в раствор, чтобы осадить барий?
827. В 100 мл раствора содержится 0,01 экв. ионов Sr2+. Сколько молей K2CrO4 следует ввести в раствор, чтобы осадить стронций?
5. Окислительно-восстановительные реакции
Окислительно-восстановительными называются химические реакции, сопровождающиеся изменением степени окисления атомов элементов.
Окисление – процесс отдачи электронов, а восстановление – процесс принятия электронов. Окисление и восстановление взаимосвязаны.
Окислитель – вещество, атомы которого принимают электроны, при этом он восстанавливается.
Восстановитель – вещество, атомы которого отдают электроны, при этом он окисляется.
Все окислительно-восстановительные реакции классифицируют следующим образом:
· Межмолекулярные реакции. Это реакции, в которых окислитель и восстановитель являются различными веществами:
 ;
;

где Mn+4 – окислитель; Cl–1 – восстановитель.
· Реакции внутримолекулярного окисления. Это реакции, которые протекают с изменением степеней окисления атомов различных элементов одного и того же вещества:
 ,
,

где Mn+7 – окислитель; O-2 – восстановитель.
· Реакции диспропорционирования. В этих реакциях и окислителем, и восстановителем является элемент, находящийся в промежуточной степени окисления в составе одного и того же вещества:
 ,
,

где Cl20 – окислитель и восстановитель.
О возможности того или иного вещества проявлять окислительные, восстановительные или двойственные свойства можно судить по степени окисления элементов, выполняющих эти функции.
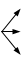
Элементы в своей высшей степени окисления проявляют только окислительные свойства, а в низшей степени окисления проявляют только восстановительные свойства. Элементы, имеющие промежуточную степень окисления, могут проявлять как окислительные, так и восстановительные свойства. Некоторые окислители и восстановители представлены в табл.5.1.
Таблица 5.1
| Вещество | Схемы реакций | |||
 KMnO4 KMnO4
|   
| |||
|  
| |||
| H2O2 | 
| |||
| Восстановители | Схемы реакций | |||
| H2S и ее соли, Na2S2O3 | 
| |||
| НГ и их соли | 
| |||
 Cr+3 Cr+3
|  
| |||
| HNO2 и ее соли |  (HNO3 или ее соли) (HNO3 или ее соли)
| |||
| H2SO3 и ее соли | 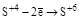 (H2SO4 или ее соли) (H2SO4 или ее соли)
| |||
| H2O2 | 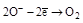
| |||
Пример 1. составить электронную схему и закончить уравнение реакции FeSO4 + K2Cr2O7 + H2SO4 → …
Решение. Степени окисления изменяются у железа Fe+2 и хрома Cr+6. Составим уравнение баланса электронов, причем расчет ведем на два атома хрома (по числу атомов в молекуле K2Cr2O7):
| 6 Fe+2 – ē → Fe+3 | |
| 1 2Cr+6 + 6ē → 2Cr+3 | |
| 6 Fe2+ + 2 Cr+6 → 2 Cr+3 + 6 Fe+3 |
Расставим полученные коэффициенты в левую и правую части исходного уравнения. Учитывая, что реакция протекает при избытке серной кислоты, конечным продуктом реакции будут сульфаты всех металлов. Водород образует воду. Недостаток сульфат-ионов слева компенсируют 7 моль серной кислоты. В последнюю очередь уравнивают реакцию по водороду (7 Н2О). Проверку следует вести по кислороду (по 59 атомов слева и справа).
Окончательно
6 FeSO4 + K2Cr2O7 + 7 H2SO4 →
→ 3 Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + 7 H2O.
Пример 2. Закончить и уравнять реакцию С6Н12О6 + + КМnО4 + Н2SО4 → СО2 + …
Решение. Необходимо составить схему процесса. В кислой среде перманганат-ион восстанавливается до иона марганца со степенью окисления +2. Для уравнивания числа атомов кислорода добавляют воду или ионы Н+ в кислой среде или ОН- в щелочной:
МnО4- + 8 Н+ + 5 e- → Мn2+ + 4 Н2О.
Восстановитель С6Н12О6 окисляется до СО2 согласно полуреакции:
С6Н12О6 + 6 Н2О - 24 e- → 6 СО2 + 24 Н+.
Приведем число электронов к наименьшему общему кратному, в данном случае к 120. Для этого уравнения полуреакций умножим на соответствующие коэффициенты: на 24 и 5. Суммируем уравнения полуреакций, сокращая одинаковые члены в левой и правой частях. В результате получим ионное уравнение реакции
5 С6Н12О6 + 24 МnО4- + 72 Н+ → 30 СО2 + 24 Мn2+ + 66 Н2О.
Составим молекулярное уравнение реакции путем добавления к ионам имеющихся в растворе противоионов:
5 С6Н12О6 + 24 КМnО4 + 36 Н2SO4 =
= 30 СО2 + 24 МnSO4 + 66 Н2О + 12 К2SО4.
Задание I. Дописать схемы окислительно-восстановительных реакций и расставить коэффициенты в уравнениях.
1. MnO2 + KClO3 + KOH → K2MnO4 + KCl + …
2. HgS + HNO3 + HCl → S + NO + …
3 SO2 + Br2 + H2O → H2SO4 + …
4. Mn(OH)2 + Cl2 + KOH → MnO2 + KCl + …
5. K[Cr(OH)4] + Br2 + KOH → K2CrO4 + …
6. Cl2 + S + H2O → H2SO4 + …
7. K2MnO4 + Cl2 → KMnO4 + …
8. KNO3 → KNO2 + O2 + …
9. AgNO3 → Ag + NO2 + O2 + …
10. Pb(NO3)2 → PbO + NO2 + O2 + …
11. NO2 + H2O → HNO3 + NO + …
12. Ca(OH)2 + NO2 → Ca(NO3)2 + Ca(NO2)2 + …
13. KClO3 → KClO4 + KCl + …
14. I2 + Ba(OH)2 → Ba(IO3) 2 + BaI2 + …
15. H2S + O2 → SO2 + …
16. S + HNO3 → H2SO4 + NO2 + …
17. C + HNO3(K) → CO2 + NO + …
18. NH3 + O2 → NO + …
19. H2O2 + KMnO4 + H2SO4 → O2 + …
20. K3[Cr(OH)6] + Br2 + KOH → K2CrO4 + …
21. H2S + K2Cr2O7 + H2SO4 → S + …
22. KNO2 + KMnO4 + H2O → KNO3 + …
23. KNO2 + KMnO4 + KOH → KNO3 + …
24. K4[Fe(CN)6] + H2O2 + H2SO4 → K3[Fe(CN)6] + …
25. K3[Fe(CN)6] + H2O2 + KOH →K4[Fe(CN)6] + O2 + …
26. Zn + KClO3 + KOH → K2[Zn(OH)4] + KCl + …
27. Al + KNO3 + KOH → K3[Al(OH)6] + NH3 + …
28. Al + NaOH + H2O → Na3[Al(OH)6] + …
29. K2[Sn(OH)4] + KOH + Bi(NO3)3 → K2[Sn(OH)6] + Bi + …
30. SnCl2 + HCl + HNO3 → H2[SnCl6] + NO + …
31. SnCl2 + HgCl2 + HCl → Hg + H2[SnCl6] + …
32. KNO2 + KMnO4 + H2SO4 → KNO3 + …
33. Cu2O + HNO3 → NO2 + …
34. FeSO4 + KClO3 + H2SO4 → KCl + …
35. CuCl2 + SO2 + H2O → CuCl + …
36. CrCl3 + Br2 + KOH → K2CrO4 + …
37. H2O2 + KI + H2SO4 → I2 + …
38. H2S + H2O2 → H2SO4 + …
39. H2S + H2SO3 → …
40. H2O2 + HIO3 → I2 + …
41. H2O2 + K2Cr2O7 + H2SO4 →…
42. K2Cr2O7 + H2S + H2SO4 → SO2 + …
43. Hg2(NO3)2 + O2 + HNO3 → Hg(NO3)2 + …
44. NaCrO2 + H2O2 + NaOH → Na2CrO4 + …
45. HBr + HBrO3 → Br2 + …
46. HClO + H2O2 → HCl + …
47. CrO3 + HCl → Cl2 + …
48. PH3 + KMnO4 + H2SO4 → H3PO4 + …
49. NaBr + NaBrO3 + H2SO4 → Br2 + …
50. SnS + HNO3 → NO + …
51. HgI2 + H2O2 + H2SO4 → I2 + …
52. KMnO4 + MnSO4 + H2O → MnO2 + …
53. H2MnO4 → HMnO4 + MnO2 + …
54. Hg + HNO3(в.р.) → NH3 + …
55. K2Cr2O7 + SnCl2 + HCl → K2[SnCl6] + …
56. Na[Cr(OH)4] + NaClO3 + NaOH → Na2CrO4 + NaCl + …
57. FeS2 + HNO3 → Fe(NO3)3 + NO + …
58. Fe3O4 + HNO3 → Fe(NO3)3 + NO + …
59. Fe3O4 + H2SO4 → Fe2(SO4)3 + SO2 + …
60. CuFeS2 + HNO3 → FeSO4 + CuSO4 + NO + …
61. As2S2 + HNO3 → H3AsO4 + H2SO4 + NO + …
62. Zn + HNO3(в.р.) → N2 + Zn(NO3)2 + …
63. SnCl2 + Cl2 + KOH → …
64. MnSO4 + Br2 + H2O → HMnO4 + …
65. FeSO4 + KBrO3 + H2SO4(pазб) → …
66. Fe(OH)3 + Cl2 + KOH → KClO3 + …
67. HClO + KI → …
68. HClO + H2S → …
69. HClO4 + H2SO3 → …
70. HClO4 + C → …
71. K2S + KMnO4 + H2SO4(разб.) → …
72. P + KOH + H2O → K2HPO4 + …
73. NO2 + KOH → KNO3 + …
74. K2MnO4 + H2SO4(разб.) → MnO2 + KMnO4 + …
75. MnSO4 + NaBiO3 + H2SO4(разб.) → …
76. KMnO4 + NaI + H2O → …
77. MnSO4 + PbO2 + HNO3 → HMnO4 + …
78. MnSO4 + KClO3 + H2O → HMnO4 + …
79. KMnO4 + H2O2 + H2O → …
80. SnCl2 + NaBiO3 + HClp → SnCl4 + …
81. Cl2 + I2 + H2O → …
82. HBrO + HBr → …
83. Ca(ClO2)2 + NaI + H2SO4 → …
84. NaClO + Na2S + H2SO4(разб.) → …
85. NaIO3 + Cl2 + KOH → …
86. KClO3 + S → …
Не нашли, что искали? Воспользуйтесь поиском: