
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Аналіз суміші NaHCO3 і Na2CO3.
Завдання для самостійної роботи:
1. Розрахувати значення рН (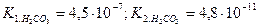 ).
).
а) 0,1М розчину NaHCO3;
б) 0,1М розчину Na2CO3;
в) розчину, отриманому змішуванням рівних об’ємів 0,1М розчину Na2CO3 та 0,01M розчину NaHCO3.
2. Розрахувати значення молярної маси еквіваленту:
а) Na2CO3 в реакції Na2CO3 + НС1 = NaHCO3 + Н2О;
б) NaHCO3 в реакції NaHCO3 + НС1 = NaС1 + Н2О + СО2.
3. Концентрація розчину NaОН рівна 0,02 моль/л. Розрахувати:
а) масу NaОН, що міститься в 100 мл розчину;
б) титр розчину NaОН, ТNaОН;
в) титр розчину NaОН за сульфатною кислотою,  .
.
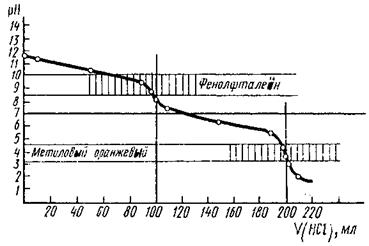
На кривій титрування карбонат-іонів кислотою спостерігаються два скачки титрування (рис.1): перша точка еквівалентності (рН 8,34) – карбонат-іони переходять в гідрогенкарбонат-іони:
Na2CO3 + НС1 = NaHCO3 + NaС1 (1);
друга точка еквівалентності (рН 4,25) – гідрогенкарбонат-іони переходять в вугільну кислоту
Na2CO3 + НС1 = NaС1 + Н2О + СО2 (2).
Суміш NaHCO3 + Na2CO3 можна відтитрувати, застосувавши два індикатори.
|
Рис 1. Крива титрування 0,1М розчину Na2CO3 0,1М розчином НС1.
Обладнання і реагенти:
Піпетки, бюретка, конічні колби для титрування, мірний циліндр, мірна колба ємністю 100 мл.
Хлоридна кислота, HCl, 0,1000М стандартний розчин.
Індикатори: метиловий оранжевий, 0,1%-ний водний розчин;
фенолфталеїн, 0,1%-ний розчин в 60%-ному етанолі.
Не нашли, что искали? Воспользуйтесь поиском: