
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Характеристика частинок, що входять до складу атома 1 страница
Великобудський НВК
| Алгоритми та методичні рекомендації по розв’язуванню розрахункових задач з хімії |
Даскалу Юліана Костянтинівна
вчитель хімії Великобудського НВК
Герцаївського р-ну
Чернівецької обл.
Р.
Схвалено радою районного методичного кабінету
відділу освіти, молоді та спорту
Герцаївської районної державної адміністрації
Протокол №4 від 13 червня 2013
Завідуючий рай методкабінетом
Лукіянчук М. І.
Автор:
Даскалу Ю. К. – вчитель хімії Великобудського НВК
Рецензенти:
Лукіянчук М. І. – завідуючий районним методичним кабінетом відділу освіти, молоді та спорту Герцаївської районної адміністрації
Сопрович Д. М. – вчитель хімії Острицької ЗОШ І – ІІІ ст., вчитель методист
Райляну О.І. – вчитель хімії Молницької ЗОШ І – ІІІ ст., «старший вчитель».
Цей посібник написано для учнів старших класів, які планують скласти ЗНО з хімії.
Уміння розв’язувати задачі є основним показником творчого засвоєння предмета.
У посібнику вміщено задачі різного рівня складності. У всіх розділах задачі подані розв'язками. Пропонований посібник містить вправи, що змістовно охоплюють майже всі розділи програмових вимог до зовнішнього незалежного оцінювання з хімії.
Структура посібника дозволяє використовувати запропоновані завдання як для перевірки знання окремих тем, так і для підсумкового контролю.
При самостійній підготовці до тестування рекомендуємо учням спочатку повторити теоретичний матеріал шкільного курсу з хімії.
Посібник рекомендований випускникам та абітурієнтам. Також він буде корисним учням старших класів та вчителям.
Хімія. Алгоритми та методичні рекомендації по розв’язуванню розрахункових задач з хімії.
Навчальний посібник – Герца, 2013 р.
ЗМІСТ
В С Т У П
Розділ 1. Обчислення за хімічними формулами
1.1.Знаходження відносної молекулярної маси і визначення масової частки елемен1.2. Визначення кількості речовини, молярної маси речовини
1.3. Обчислення відношення мас елементів у складній речовині за її формулою
1.4. Молярний об’єм газів. Закон Авогадро.
1.5. Обчислення з використанням газових законів
Розділ ІІ. Розчини.
2.1. Обчислення масової частки і маси речовини в розчині
2.2. Обчислення молярної концентрації розчинів
2.3. Розв’язування задач з використанням поняття розчинності речовин
2.4. Розв’язування задач з використанням поняття викристалізації речовин
2.5. Обчислення на приготування розчинів з масовою часткою речовини з кристалогідратів
2.6. Обчислення на змішування розчинів
Розділ ІІІ. Обчислення за рівняннями хімічних реакцій
3.1. Обчислення кількості речовини, маси чи об’єму речовини за рівнянням реакції
3.2.Розв’язування задач на домішки
3.3.Розв’язування задач на вихід продукту від теоретично можливого
3.4. Розв’язування задач на надлишок однієї з реагуючих речовин
3.5. Обчислення за термохімічними рівняннями.
3.6. Розв'язування задач на суміші
Розділ 1V. Розв'язування задач на встановлення формул органічних сполук
4.1. Виведення молекулярної форми відомого класу органічних сполук за відносною густиною
4.2. Виведення молекулярної формули за відомими масовими частками елементів
4.3. Виведення молекулярної формули за відомими масою, об’ємами або кількістю речовини продуктів згорання
4.4. Виведення молекулярної формули за об’ємом кисню, необхідного для спалювання органічної речовини
4.5. Виведення молекулярної формули за об’ємними відношеннями газів
4.6. Виведення молекулярної формули за рівнянням стану ідеальних газів
Список використаної літератури
Додатки
В С Т У П
Хімія-одна із найважливіших природничих наук,яка відіграла значну роль у створенні сучасної наукової картини світу. Ми на кожному кроці бачимо необхідні в нашому житті предмети, виробництво яких неможливе без застосування хімічних знань. Цікаві і разом з тим складні процеси у величезній кількості відбуваються в живих організмах. Звідси зрозуміло, що людям,які мріють присвятити своє життя медицині чи фармакології,металургії чи нафтохімії, парфюмерії чи сільському господарству, потрібні знання хімії.
Проте, майбутньому вченому-хіміку мало знати і вміти пояснювати ті чи інші хімічні явища з якісної сторони, їх потрібно характеризувати ще й кількісно. Це вміння формується у процесі систематичного розв`язування розрахункових задач. Памятаючи,що хімія належить до точних наук,потрібно дуже відповідально ставитись до математичних розрахунків.
Розв’язування розрахункових задач з хімії – одна зі складових хімічної освіти поряд з вивченням і засвоєнням теоретичного матеріалу та опануванням технікою експерименту. Уведення задач в навчальний процес дає змогу реалізувати такі дидактичні принципи навчання: забезпечення самостійності й активності учнів; досягнення єдності знань і умінь; встановлення зв’язків навчання з життям.
У ході розв’язування задач з хімії забезпечується: вироблення оптимальної методики підходу до теоретичного обґрунтування умови задачі; єдність навчання, розвитку, виховування учнів; закріплення правил, термінів, законів, рівнянь; осмислення зв’язку фізичних величин, політехнічну підготовку знань учнів; конкретизація, систематизація, зміцнення і перевірка знань учнів; поєднання теорії з практикою, вміння втілювати свої знання у життя; розвиток логічного мислення, активізація розумової діяльності, виховання ініціативності, самостійності, уважності; ілюстрація хімічних закономірностей, принципів хімічної технології, хімізації народного господарства, продуктивності апаратів, якості та виходу готового продукту;
Задачі відіграють значну роль в організації пошукових ситуацій, необхідних у проблемному навчанні, а також у здійсненні перевірки знань учнів і закріплення засвоєного матеріалу.
Розділ 1. Обчислення за хімічними формулами
1.1.Знаходження відносної молекулярної маси і визначення масової частки елементів у речовині
Відносна молекулярна маса речовини позначається Мr і обчислюється як сума добутків атомних мас елементів, що входять до складу сполуки, на кількість атомів елемента у даній сполуці:
Mr(AxByCz)= x·Ar(A)+y·Ar(B)+z·Ar(C)
Приклад
Обчислити відносну молекулярну масу кальцій карбонату СаСО3.
Mr(СаСО3)= 1·Ar(Са)+1·Ar(С)+3·Ar(О)= 40+12+3 ·16=100
Для визначення масової частки елемента у сполуці користуються формулою:
ω% (E) = 
Де ω% (E) – масова частка елемента у сполуці;
n - кількість атомів елемента у сполуці;
Ar (E) – відносна атомна маса цього елемента;
Mr (сполуки) – відносна молекулярна маса даної сполуки.
Приклад
Визначити масову частку Оксигену в кальцій карбонаті СаСО3.
| Дано: | Розв’язання: |
| СаСО3 | 1. Mr(СаСО3)= 1·Ar(Са)+1·Ar(С)+3·Ar(О)= 40+12+3 ·16 =100
2. ω% (О)= 
|
| ω% (О)-? | |
| Відповідь: ω% (О)= 48% |
1.2. Визначення кількості речовини, молярної маси речовини
Кількість речовини
ν (X) =  ; ν (X) =
; ν (X) =  ; NA = 6,02 · 1023 моль -1
; NA = 6,02 · 1023 моль -1
ν (X) – кількість речовини Х,
m – маса речовини Х,
М – молярна маса речовини Х;
N – число структурних одиниць (атомів чи молекул);
NA – число Авогадро.
Молярна маса речовини – маса 1 моля речовини. Вона чисельно дорівнює відносній молекулярній масі, одиниці вимірювання – г/моль.
М(СаСО3) = 100 г/моль
Приклад
Скільки атомів містить залізо масою 1,12 г?
| Дано: | Розв’язання: |
| m(Fe)=1,12 г | 1. ν (Fe) = 1,12: 56 = 0,02 (моль) 2. Nат (Fe) =0,02· 6,02· 1023 =1,2·1022атомів |
| Nат (Fe) -? | |
| Відповідь: 1,2·1022атомів |
1.3. Обчислення відношення мас елементів у складній речовині за її формулою
Приклад
Обчислити співвідношення мас Феруму й Оксигену в ферум (ІІІ) оксиді.
| Дано: | Розв’язання: |
| Fe2O3 | ν (А): ν (В): ν (С) = х: у: z ν (Fe): ν (О) = 2: 3 m (Fe): m (O) = 2М(Fe): 3М(O); m (Fe): m (O) = (2·56): (3·16) = 112: 48 = 7: 3 |
| m(Fe):m(O) -? | |
| Відповідь: співвідношення мас елементів Феруму й Оксигену в ферум (ІІІ) оксиді становить 7: 3. |
1.4. Молярний об’єм газів. Закон Авогадро.
Обчислення відносної густини газів
Закон Авогадро: в однакових об’ємах різних газів за однакових умов міститься однакова кількість молекул.
Разом з тим 1 моль будь-якого газу містить однакову кількість молекул. Отже, за однакових умов 1 моль будь-якого газу займає один і той же об’єм. Цей об’єм називається мольним об’ємом газу і за нормальних умов становить 22,4 л/моль.
Опорні формули:
Vm =  , Vm = 22,4 л/моль;
, Vm = 22,4 л/моль;
Оскільки 1 моль (за н.у.) займає об’єм 22,4 л, то, знаючи масу 1 л газу (за н.у.), можна обчислити молярну масу цього газу:
М = Vm·ρ,
де ρ – густина, тобто маса 1 л даного газу (за н.у.)
Відносна густина газу одного газу (Х) за другим (Y) позначається DX(Y). Це безрозмірна величина, яка обчислюється відношенням маси певного газу до маси такого самого об’єму іншого газу, взятих за однакових температури і тиску.
DХ(Y) = 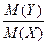 ;
;
Відносна густина деякого газу ( Y) за водне: DН2 (Y) =  ;
;
Відносна густина деякого газу (Y) за повітрям: Dпов(Y) =  ;
;
Повітря – це суміш газів, тому підставляємо значення середньої молярної маси повітря – М(пов)=29 г/моль.
Відносна густина газової суміші – відношення середньої молярної маси цієї суміші до молярної маси газу, за яким її визначають:
DХ(газов. суміші ) = 
Середня молярна маса газової суміші Мсер. газ. сум. дорівнює сумі добутків молярної маси газу на його мольну частку ( χ ) (чи об’ємну частку (φ)) в складі газової суміші:
М сер. газов. суміші = М1χ1+М2 χ 2+…
або М сер. газов. суміші = М1φ1+М2 φ 2+…
Мольна частка ( χ ) – це відношення кількості речовини одного компонента суміші до суми кількостей речовини усіх складових суміші:
χ =  ;
;
υ (заг) = υ (А) + υ (В) +...
Об’ємна частка (φ) – це відношення об’єму газу одного з компонентів суміші до суми об’ємів газів усіх компонентів суміші(об’єму газової суміші):
φ =  ;
;
V(газ. сум.) = V (A) + V(B) + …
Приклад
Обчислити відносну густину карбон (ІV)оксиду за повітрям.
| Дано: | Розв’язання: |
| СО2 | Дпов(Y)=  ; М(пов)=29 г/моль; М(СО2)= 44 г/моль
Дпов(СО2)= ; М(пов)=29 г/моль; М(СО2)= 44 г/моль
Дпов(СО2)= 
|
| Дпов(СО2) -? | |
| Відповідь: відносна густина СО2 за повітрям дорівнює 1,52. |
Приклад
Обчислити густину за воднем газової суміші, що містить 0,4 об’ємних частки вуглекислого газу, 0,3 об’ємних частки нітроген (ІУ) оксиду і 0,3 об’ємних частки азоту.
| Дано: | Розв’язання: |
| φ (СО2)= 0,4 φ (NO2)= 0,3 φ (N2) = 0,3 | ДН2 (сум.)=  ;
1. Яка середня молярна маса газової суміші?
Мсер.(сум.)=М(СО2)· (СО2)+М(NO2)· (NO2)+M(N2)·(N2)
Mсер. (сум.)=44·0,4+46·0,3+28·0,3= 39,8 (г/моль)
2. Яка відносна густина суміші за воднем?
ДН2 (газ. сум.) = ;
1. Яка середня молярна маса газової суміші?
Мсер.(сум.)=М(СО2)· (СО2)+М(NO2)· (NO2)+M(N2)·(N2)
Mсер. (сум.)=44·0,4+46·0,3+28·0,3= 39,8 (г/моль)
2. Яка відносна густина суміші за воднем?
ДН2 (газ. сум.) = 
|
| ДН2 (суміші)-? | |
| Відповідь: відносна густина газової суміші за воднем дорівнює 19,9. |
1.5. Обчислення з використанням газових законів
Закон Бойля – Маріотта: при сталій температурі тиск, що спричиняє дана маса газу, обернено пропорційний об’єму газу.
 або pV = const
або pV = const
Закон Гей-Люссака (1): при сталому тиску об’єм газу змінюється прямо пропорційно абсолютній температурі:
 або
або  const
const
Об’єднаний газовий закон виражає залежність між об’ємом газу, тиском і температурою (об’єднує закони Бойля – Маріотта та Гей–Люссака):
 ;
;
де р0, V0, Т0 – тиск, об’єм та температура за нормальних умов,
р, V, Т – тиск, об’єм та температура за інших умов
Нормальні умови: p0 = 101,3 кПа = 1 атм. = 760 мм рт. ст.
Т0=273 К.
Стандартні умови: p0 = 101,3 кПа = 1 атм. = 760 мм рт. ст.
Т0=298 К.
φ =  ; φ - об’ємна частка
; φ - об’ємна частка
Рівняння Менделєєва – Клапейрона
р V = νRT, ν =  р V =
р V =  RT
RT
R – універсальна газова стала,
R = 8,31 кДж/моль·К = 0,082 л·атм/моль·К = 62630 мл·мм рт.ст./ моль·К
Закон Гей-Люссака (2): об’єми реагуючих і утворених газоподібних речовин відносяться між собою як прості цілі числа або коефіцієнти в рівняннях реакцій:
V1: V2: V3 = ν1: ν2: ν3
Приклад
Обчислити об’єм азоту і водню, необхідних для синтезу амоніаку (NH3) об’ємом 60 м3.
| Дано: | Розв´язання: |
| V(NH3)=60м3 | N2 + 3H2 D 2NH3 ν (N2): ν (H2): ν (NH3) = 1: 3: 2 V(N2): V(H2): V(NH3) = 1: 3: 2 x: y: 60 = 1: 3: 2 x: 60 = 1: 2; x = 30 (л) y: 60 = 3: 2; y = 90 (л) |
| V(N2) -? V(H2) -? | |
| Відповідь: об´єм азоту 30 л, об´єм водню 90 л. |
Приклад
За нормальних умов 1 г повітря займає об’єм 773 мл. Який об’єм займе та ж маса повітря при 00С та тиску, рівному 93,3 кПа?
| Дано: | Розв´язання: |
| m (пов) = 1 г V0 (пов) = 0,773 л t = 00C р = 93,3 кПа |  ; V = ; V =  ;
V = ;
V =  =0,84 (л) =0,84 (л)
|
| V (пов) -? | |
| Відповідь: об´єм повітря 0,84 л. |
Розділ ІІ. Розчини.
2.1. Обчислення масової частки і маси речовини в розчині
Масова частка розчиненої речовини в розчині (ω (%) (р.р.)) – це відношення маси розчиненої речовини до загальної маси розчину.
Розчинник

|

|


ω (р.р.) =  , якщо концентрація у частках від одиниці.
, якщо концентрація у частках від одиниці.
ω (р.р.) =  , якщо концентрація у відсотках
, якщо концентрація у відсотках
ω (р.р.) – масова частка розчиненої речовини
m (р.р.) – маса розчиненої речовини
m (розчину) – маса розчину
m (розчину) = m (р.р.) + m (Н2О) чи іншого розчинника
Якщо відомий об’єм розчину і його густина, то масу розчину знаходять за формулою m (розчину) = V ∙ρ
Виходячи з вищезазначеного, формула набуває вигляду:
ω (р.р.) = 
Приклад
Обчислити масову частку цукру в розчині, приготовленому при розчиненні 20 г цукру в 180 г води.
| Дано: | Розв’язання: |
| m (р.р.)=20 г m (Н2О)=180 г | 1. ω) (р.р.)=  2. ω (р.р.)=
2. ω (р.р.)= % %
|
| ω (р.р.) -? | |
| Відповідь: масова частка цукру 10% |
Приклад
Визначити масу та об’єм води, в якій потрібно розчинити 60 г солі, щоб утворився 25%-ний її розчин.
| Дано: | Розв’язання: |
| m (р.р.)=60 г ω (%) (р.р.) = 25 | 1. Записуємо формулу для обчислення масової частки
ω (р.р.)=  m (роз)= m (р.р.) + m (Н2О)
2. Підставляємо значення:
25 % =
m (роз)= m (р.р.) + m (Н2О)
2. Підставляємо значення:
25 % =  0,25(60 + х) = 60
15 + 0,25х = 60
0,25х = 35
х =140 – це m (Н2О)
3. Знаходимо об’єм води:
m (розчину) = V ∙ρ, V = m (розчину)/ ρ
ρ (Н2О) = 1 г/см3
V =
0,25(60 + х) = 60
15 + 0,25х = 60
0,25х = 35
х =140 – це m (Н2О)
3. Знаходимо об’єм води:
m (розчину) = V ∙ρ, V = m (розчину)/ ρ
ρ (Н2О) = 1 г/см3
V =  (см3) (см3)
|
| m(Н2О) -? | |
| Відповідь: маса води становить 140 г, об’єм – 140 см3. |
Приклад
Визначити масову частку хлоридної кислоти в розчині, утвореному при додаванні 200 мл води до 300 г 40% її розчину.
| Дано: | Розв’язання: |
| V(H2O) = 200 мл m1(розч)=300 г ω % (HCl) = 25% | 1. Яку масу води додали до розчину?
m = ρ∙V; ρ (H2O) = 1 г/мл
m (H2O) = 200 ∙ 1 = 200 (г)
2. Яка маса утвореного розчину?
m2(розч)= m1(розч)+ m(H2O)
m2(розч)=300 +200 = 500 (г)
3. Яка маса хлоридної кислоти у вихідному розчині?
m(HCl) =  (г)
4. Записуємо формулу для обчислення масової частки
ω (р.р.)= (г)
4. Записуємо формулу для обчислення масової частки
ω (р.р.)=  ω2 (р.р.)=
ω2 (р.р.)=  = 15% = 15%
|
| ω2(HCl) -? | |
| Відповідь: масова частка хлоридної кислоти в утвореному розчині становить 15% |
Приклад
Визначити масову частку кухонної солі в розчині, одержаному при додаванні 25 г натрій хлориду до 200 г розчину з масовою часткою солі 0,25.
| Дано: | Розв’язання: |
| m (NaCl)=60 г m1(poзч)=200г ω1 (NaCl) = 0,25 | 1. Яка маса солі містилась у вихідному розчині?
m1(NaCl)р.р.=200∙0,25 = 50 (г)
2. Яка маса розчиненої речовини в утвореному розчині?
m2(NaCl)р.р.= m1(NaCl)р.р.+ m (NaCl)= 50+60 = 110 (г)
3. Яка маса утвореного розчину?
m2(poзч)= m1(poзч) + m (NaCl)= 200 + 60 = 260 (г)
4. Якою буде масова частка утвореного розчину?
ω2 (р.р.)=  ω2 (NaCl)=
ω2 (NaCl)=  = 42,3% = 42,3%
|
| ω2(NaCl) -? | |
| Відповідь: маса води становить 140 г, об’єм – 140 см3. |
Приклад
Визначити масову частку калій гідроксиду в розчині, одержаному при розчиненні 7,8 г калію в 200 мл води.
| Дано: | Розв’язання: |
| m (К)=7,8 г V (Н2О) = 200 мл | 1. m = ρ∙V; ρ (H2O) = 1 г/мл
m (H2O) = 200 ∙ 1 = 200 (г)
2. 2К + 2Н2О = 2КОН + Н2↑
2 моль 2 моль 1 моль
М=39 г/моль М=56г/моль М=2 г
m = 78 г m = 112 г m= 2 г
7,8 г х г у г
х = 11,2 (г) у = 0,2 (г)
3. m (розч) = m (К)+ m (H2O) – m (H2) = (7,8 + 200) – 0,2 =
= 207,6 (г)
4. ω) (р.р.)=  = 5,4% = 5,4%
|
| ω%(КОН) -? | |
| Відповідь: масова частка калій гідроксиду 5,4 % |
2.2. Обчислення молярної концентрації розчинів
Молярна концентрація показує, яка кількість розчиненої речовини міститься в певному об’ємі розчину.
с (Х) =  ; ν =
; ν =  с (Х) =
с (Х) =  (моль/л)
(моль/л)
Якщо відома масова частка розчиненої речовини в розчині та густина розчину, можна використати формулу:
с (Х) = 
Часто молярну концентрацію речовини в розчині позначають великою літерою М біля цифри, що зазначає її.
Наприклад, розчин з молярною концентрацією 2 моль/л – це 2М розчин.
Розчин з молярною концентрацією речовини 0,1 моль/л – 0,1М розчин.
Приклад
Визначити молярну концентрацію натрій хлориду в його розчині об’ємом 100мл, якщо там міститься 56 г солі.
| Дано: | Розв’язання: |
| m (NaCl)=56 г V (розч)=100 мл | 1. с (Х) =  2. с (NaCl) =
2. с (NaCl) =  =0,97 моль/л =0,97 моль/л
|
| c (NaCl) -? | |
| Відповідь: молярна концентрація солі становить 0,97 моль/л. |
2.3. Розв’язування задач з використанням поняття розчинності речовин
Розчинність виражається масою речовини, що здатна розчинятись у певній масі або об’ємі розчинника, утворюючи насичений розчин. Найчастіше розчинність виражають кількістю грамів речовини, що може розчинитись при певній температурі у 100г розчинника.
S =  розчинника (Н2О)
розчинника (Н2О)
S – розчинність речовини
Приклад
При випарюванні насиченого при 100С розчину натрій хлориду масою 200 г одержали твердий залишок масою 52,6 г. Обчислити розчинність натрій хлориду при даній температурі.
| Дано: | Розв’язання: |
| m (NaCl)р=200 г m (NaCl)=52,6 г t = 100C | 1. S (Х) =  2. m(Н2О) = 200 – 52,6 = 147,4 (г)
3. s (NaCl)=
2. m(Н2О) = 200 – 52,6 = 147,4 (г)
3. s (NaCl)=  =35,7 (г) =35,7 (г)
|
| S (NaCl) -? | |
| Відповідь: розчинність натрій хлориду становить 35,7 г. |
2.4. Розв’язування задач з використанням поняття викристалізації речовин
Приклад
Розчинність натрій фториду при 400С становить 4,5 г, а при 00С – 4,1 г. Яка маса солі викристалізується при охолодженні насиченого при 400С розчину масою 540 г до00С?
Не нашли, что искали? Воспользуйтесь поиском: