
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Характеристика частинок, що входять до складу атома 3 страница
4.1. Виведення молекулярної форми відомого класу органічних сполук за відносною густиною
Приклад
Відносна густина пари деякого алкану за повітрям дорівнює 3,931. Визначте формулу цього алкану і назвіть його.
 Дано: Розв’язування:
Дано: Розв’язування:
СnH2n+ 2 M(CnH2n+2)= (14n +2) г/моль
D(CnH2n+2)пов= 3,931 1. Обчислимо молярну масу алкану:
 СnH2n+2 -? M(CnH2n+2) = D(CnH2n+2)пов
СnH2n+2 -? M(CnH2n+2) = D(CnH2n+2)пов  Mпов;
Mпов;
Mпов=29г/моль
M(CnH2n+2) = 3,931  29 г/моль = 114 г/моль
29 г/моль = 114 г/моль
2. Обчислимо число атомів Карбону в алкані:
12n + 2 = 114; 14n = 112;  ; С8Н18
; С8Н18
Відповідь: Формула сполуки С8Н18. Це октан.
4.2. Виведення молекулярної формули за відомими масовими частками елементів
Приклад
Виведіть молекулярну формулу вуглеводню, масова частка Карбону в якому становить 82, 75%, а Гідрогену 17,25%. Відносна густина пари цього вуглеводню за повітрям дорівнює 2.
 Дано: Розв’язування:
Дано: Розв’язування:
ω(С) = 82,75% 1. Обчислюємо молярну масу вуглеводню:
ω(Н) = 17,25% 
 D(CxHy)пов = 2 2. Виводимо алгоритм для встановлення кількості атомів Карбону
D(CxHy)пов = 2 2. Виводимо алгоритм для встановлення кількості атомів Карбону
та Гідрогену:
CxHy -? 

3. Обчислюємо число атомів Карбону і Гідрогену у вуглеводні (для розрахунків відсотки переводимо в частки):

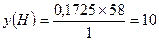
Формула вуглеводню С4Н10
4. Робимо перевірку виведеної формули вуглеводню за молярною масою:
М(С4Н10)=58г/моль
Відповідь: формула вуглеводню С4Н10 (бутан)
4.3. Виведення молекулярної формули за відомими масою, об’ємами або кількістю речовини продуктів згорання
Приклад
Внаслідок спалювання вуглеводню масою 1,5 г утворилися оксид карбону (ІV) об’єму 2,24 л (н.у.) та вода масою 2,7 г. Виведіть формулу вуглеводню, якщо відносна густина його за повітрям становить 1,0345.
 Дано: Розв’язування:
Дано: Розв’язування:
m(CxHy)=1,5г 1. Обчислимо молярну масу вуглеводню:
V(C xHy)=2,24 л 
 m(H2O)=2,7г Mпов = 29 г/моль
m(H2O)=2,7г Mпов = 29 г/моль
 D(CxHy)пов=1,0345
D(CxHy)пов=1,0345 
CxHy -? 2. Обчислимо кількість речовини вуглеводню масою 1,5 г:

3. Обчислимо кількість речовини оксиду карбону (ІV) об’ємом 2,24 л:

4. Обчислимо кількість речовини води масою 2,7 г:

5. Обчислимо співвідношення кількостей речовин вуглеводню, оксиду карбону (ІV) та води:
υ (CxHy): υ (СО2): υ (Н2О) = 0,05: 0,1: 0,15

6. Обчислимо число атомів Карбону і Гідрогену у вуглеводні:
СхНу + О2 → 2 СО2 + 3Н2О
х=2; у=6; С2Н6; М(С2Н6) = 30 г/моль
Відповідь: Формула вуглеводню С2Н6 (етан)
4.4. Виведення молекулярної формули за об’ємом кисню, необхідного для спалювання органічної речовини
Приклад
На спалення 0,5 моль етиленового вуглеводню витрачається 33,6 л кисню (н.у.). Встановити формулу сполуки.
 Дано: Розв’язування:
Дано: Розв’язування:
υ(СnH2n) = 0,5 моль 1. Знаходимо кількість кисню:
 V(O2) = 33,6 л
V(O2) = 33,6 л 
СnH2n -? 2. Складаємо рівняння реакції горіння етиленового
вуглеводню у загальному вигляді і розставляємо коефіцієнти:
СnH2n + хO2 → nСО2 + nН2О
n+2n=2x
3n=2x

3 .Складаємо пропорцію:
На 1 моль СnH2n йде 1,5 моль O2 (n)
На 0,5 моль СnH2n йде 1,5 моль О2 (за умовою)

Отже, у молекулі етиленового вуглеводню два атоми Карбону. А на два атоми Карбону припадає чотири атоми Гідрогену. Формула вуглеводню С2Н4, це етилен.
Відповідь: формула вуглеводню С2Н4 (етилен)
4.5. Виведення молекулярної формули за об’ємними відношеннями газів
Приклад
При дегідратації первинного насиченого спирту утворився газоподібний алкен, об’єм якого виявився в 4 рази меншим, ніж об’єм карбон(VI)оксиду, що утворився при спалювані такої ж кількості спирту. Одержаний алкен може повністю знебарвити розчин бромованої води, де міститься 16г брому. Який спирт піддали дегідратації?
Дано: Розв’язування:
 Складаємо рівняння відповідних реакцій:
Складаємо рівняння відповідних реакцій:

 m(Br2) = 16г 1) Дегідратація первинного насиченого спирту:
m(Br2) = 16г 1) Дегідратація первинного насиченого спирту:
 СnH2n+1OH -? СnH2n+1OH СnH2n + H2O
СnH2n+1OH -? СnH2n+1OH СnH2n + H2O
2) Горіння первинного насиченого спирту:
 СnH2n+1OH + О2 СО2 + Н2О
СnH2n+1OH + О2 СО2 + Н2О
3) Приєднання брому алкеном:
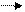 СnH2n + Br2 СnH2n Br2
СnH2n + Br2 СnH2n Br2
Складаємо співвідношення реагуючих речовин та продуктів реакції:
V(СnH2n): V (CO2) = 1:4
4) Знаходимо кількість речовини Брому:
 , за рівнянням υ(СnH2n) = 0,1 моль
, за рівнянням υ(СnH2n) = 0,1 моль
5) За умовою задачі:
 1V СnH2n 4V CO2
1V СnH2n 4V CO2
υ(СnH2n) = 0,1 моль
υ(CO2) = 0,4 моль
υ(СnH2n): υ(CO2) = 0,1: 0,4 = 1:4
6) Формула алкену містить 4 атоми Карбону:
С4Н8
При гідратації алкену добудемо одноатомний насичений спирт С4Н9ОН
Відповідь: С4Н9ОН – бутанол
4.6. Виведення молекулярної формули за рівнянням стану ідеальних газів
Приклад
 У сталеву посудину, місткість якої 2,75л, помістили 1,32г насиченого одноатомного спирту. Потім туди ввели 3,36л кисню (н. у.). Після підпалювання спирт повністю згорів, при цьому тиск у посудині за температурою 227ºС становив 306 кПа. Визначте формулу спирту.
У сталеву посудину, місткість якої 2,75л, помістили 1,32г насиченого одноатомного спирту. Потім туди ввели 3,36л кисню (н. у.). Після підпалювання спирт повністю згорів, при цьому тиск у посудині за температурою 227ºС становив 306 кПа. Визначте формулу спирту.
Дано: Р озв'язування:
Vпосуду = 2,75л 1) За рівнянням Менделєєва-Клапейрона:
m(CnH2n+1OH) = 1,32г 
V(O2) = 3,36л Виводимо формулу для визначення кількості речовини суміші продуктів
t = 227ºС згорання:
 P =306 кПа
P =306 кПа  , Т = 227 + 273 = 500 К;
, Т = 227 + 273 = 500 К;
CnH2n+1OH -? R = 8,314 

2) За законом збереження маси речовини, знаходимо масу кисню витраченого для спалювання насиченого одноатомного спирту:


3) Маса вихідних речовин:

Маса продуктів реакції:


Приймаємо υ(СО2) = х,
υ(Н2О) = 0,2025-х
Складаємо математичне рівняння за законом збереження мас речовин:
6,12 = 44х + (0,2025-х)18
6,12 = 44х + 3,645 – 18х
2,475 = 26х
х = 0,095
Отже, υ(СО2) =0,095 моль, υ(Н2О) = 0,1075 моль
4) Складаємо рівняння реакції горіння насиченого одноатомного спирту:
 CnH2n+1OH + О2 5СО2 + 6Н2О
CnH2n+1OH + О2 5СО2 + 6Н2О
За співвідношенням υ(СО2): υ(Н2О) = 0,095:0,1075 = 5:6
В сполуці спирту 5 атомів Карбону і 12 атомів Гідрогену.
Отже формула насиченого одноатомного спирту С5Н11ОН
Відповідь: С5Н11ОН – пентанол (аміловий спирт)
4.7. Виведення молекулярної формули за хімічними властивостями речовин
Приклад
Етиленовий вуглеводень, що утворився із 24 г одноатомного насиченого спирту при нагріванні з концентрованою сульфатною кислотою, приєднує 15,3 мл брому (ρ = 3,14 г/см3). Який спирт використали для реакції? Врахуйте, що масова частка виходу алкену становить 75% від теоретичного.
 Дано: Розв’язування:
Дано: Розв’язування:
m(СnH2n+1OH) = 24г 1. Визначаємо масу брому, що приєднує алкен:
V(Br2) = 15,3мл m(Br2) = ρ  V = 15,3 мл
V = 15,3 мл  3,14 г/мл = 48 г
3,14 г/мл = 48 г
ρ = 3,14 г/см3 2. Визначаємо кількість речовини брому:
 ωвих. (СnH2n) = 75% υ
ωвих. (СnH2n) = 75% υ 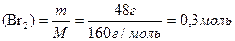
СnH2n+1OH -?
3. Складаємо рівняння відповідних реакцій:
СnH2n + Br2  СnH2nBr2
СnH2nBr2
СnH2n+1OH  СnH2n + H2O
СnH2n + H2O
4. Визначаємо практичну кількість речовини алкену, що приєднує бром:
υ(Br2) = υпр.(СnH2n) = 0,3 моль
5. Обчислимо теоретичну кількість виходу алкену:

6. Обчислимо молярну масу одноатомного насиченого спирту:

7. Обчислимо число атомів Карбону в сполуці спирту:
12n +2n +1 +17 = 60
14n =42
n=3
8. Виводимо формулу одноатомного насиченого спирту:
С3Н7OH
Відповідь: для реакції використали пропанол (С3Н7OH)
Приклад
Для каталітичного гідрування алкіну невідомого складу потрібно використати 1,7 л водню (н.у.). Така ж сама маса вуглеводню під час взаємодії з бромом утворює 15,24 г тетраброміду з розгалуженим карбоновим скелетом. Визначте формулу алкіну.
 Дано: Розв’язування:
Дано: Розв’язування:
V(H2) = 1,7 л 1. Складаємо рівняння відповідних реакцій:
m(СnH2n-2Br4) = 15,24г СnH2n-2 + 2H2  СnH2n+2
СnH2n+2
 СnH2n-2 + 2Br2
СnH2n-2 + 2Br2  СnH2n-2Br4
СnH2n-2Br4
СnH2n -? 2. Обчислимо кількість речовини водню
що вступив у реакцію каталітичного
гідрування алкіну:
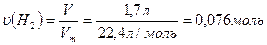
3. Обчислимо кількість речовини брому, що вступив у реакцію:
υ(Br2)= 0,076 моль
4. Обчислимо масу брому:
m(Br2) = М  υ = 160 г/моль
υ = 160 г/моль  0,076 моль = 12,16 г
0,076 моль = 12,16 г
5. Обчислимо масу алкіну:
m(СnH2n-2) = m(СnH2n-2Br4) – m(Br2) = 15,24 – 12,16 = 3,08 г
6. Обчислюємо кількість речовини алкіну за рівнянням реакції приєднання брому:
υ(СnH2n-2) = υ(Br2)/2 = 0,076/2 = 0,038 моль
7. Обчислюємо молярну масу алкіну:

8. Обчислюємо число атомів Карбону в алкіні:
12n + 2n – 2 = 82
14n = 84
n=6
9. Виводимо формулу алкіну:
С6H10
Відповідь: формула алкіну С6H10 (гексин)
Приклад
Внаслідок нагрівання насиченого одноатомного спирту з концентрованою йодидноюкислотою утворилась сполука, в якій масова частка йоду становить 74,7%. Визначте формулу одноатомного спирту.
 Дано: Розв’язування:
Дано: Розв’язування:
СnH2n+1OH СnH2n+1OH + НI → СnH2n+1I + H2O
ω  (I) = 74,7% Mr(СnH2n+1I) = 14n + 128
(I) = 74,7% Mr(СnH2n+1I) = 14n + 128
СnH2n+1OH -? 

74,7 (14n + 128) = 12700
1045,8n + 9561,6 = 12700
1045,8n = 3138,4
 ; С3Н7ОН
; С3Н7ОН
Відповідь: Формула спирту С3Н7ОН (пропанол)
Приклад
Маса продукту приєднання гідроген броміду до вуглеводню етиленового ряду виявилась у 2,929 раза більшою за масу вихідного вуглеводню.
Визначте формулу етиленового вуглеводню.
 Дано: Розв’язування:
Дано: Розв’язування:
m(CnH2n) ×2,929 = 1. Складаємо рівняння реакції:

 m(CnH2n+1Br) CnH2n + НBr CnH2n+1Br
m(CnH2n+1Br) CnH2n + НBr CnH2n+1Br
CnH2n -? 2. Приймаємо m(CnH2n) за х, згідно умови m(CnH2n+1Br)=2,929 х
3. Складаємо співвідношення за кількістю речовин реагентів і продуктів реакції:
υ(CnH2n)= υ(CnH2n+1Br)
4. Визначаємо молярні маси реагентів і продуктів реакції:
М(CnH2n)=12n +2n = 14n
M(CnH2n+1Br)=14n+81
5. Визначаємо кількості речовин:


6. Встановлюємо кількість атомів Карбону у сполуках за пропорцією:
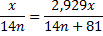
n=3
Отже, у молекулі етиленового вуглеводню 3 атоми Карбону та 6 атомів Гідрогену. Формула вуглеводню C3H6 – пропен.
Відповідь: Формула етиленового вуглеводню C3H6 (пропен).
Приклад
В результаті дії натрію на 13,8г суміші етилового спирту і одноосновної органічної кислоти виділяється 3,36л газу, а в результаті дії на таку ж саму суміш насиченого розчину гідроген карбонату натрію – 1,12л газу. Визначте будову органічної кислоти.
 Дано: Розв’язування:
Дано: Розв’язування:
mсум.(СnH2n+1COOH; 1. Складаємо рівняння реакції взаємодії
C2H5OH) = 13,8 г органічної кислоти та натрій гідроген
V1 заг.(газу) = 3,36 л карбонату:
 V2 (газу) =1,12 л СnH2n+1COOH + NaHCO3 СnH2n+1COONa+
V2 (газу) =1,12 л СnH2n+1COOH + NaHCO3 СnH2n+1COONa+
Na, NaHCO3 + H2O + CO2
 СnH2n+1COOH -? В исновок виділяється вуглекислий газ
СnH2n+1COOH -? В исновок виділяється вуглекислий газ
ω(СnH2n+1COOH) -? об’ємом 1,12 л
ω(C2H5OH) -?
2. Визначаємо кількості речовин вуглекислого газу і органічної
кислоти за рівнянням реакції:
υ(CO2) = υ.(СnH2n+1COOH)
υ(СnH2n+1COOH) = 0,05 моль
 = 0,05 моль
= 0,05 моль
3. При взаємодії натрію як з органічною кислотою так і спиртом виділяється водень:
V1 заг.(Н2) = 3,36л;

4. Складаємо рівняння реакції взаємодії органічної кислоти з натрієм:

 2СnH2n+1COOH + 2Na 2СnH2n+1COONa + H2
2СnH2n+1COOH + 2Na 2СnH2n+1COONa + H2
З попередніх розрахунків υ(СnH2n+1COOH) складає 0,05 моль, отже υ1(Н2) за рівнянням реакції дорівнює 0,025 моль:
υ2(Н2) = 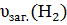 - υ1(Н2) = 0,15моль – 0,025 моль = 0,125 моль
- υ1(Н2) = 0,15моль – 0,025 моль = 0,125 моль
 5. Складаємо рівняння реакції етилового спирту з натрієм:
5. Складаємо рівняння реакції етилового спирту з натрієм:
 2C2H5OH + 2Na 2C2H5ONa + H2
2C2H5OH + 2Na 2C2H5ONa + H2
Відповідно υ(Н2) в даній реакції дорівнює υ2(Н2) = 0,125 моль, а за рівнянням υ(C2H5OH) = 0,25 моль
6. Знаходимо маси речовин у суміші:
m(C2H5OH) = M(C2H5OH) × υ(C2H5OH) = 46 г/моль × 0,25 моль =
= 11,5 г
Масу СnH2n+1COOH визначаємо за різницею маси суміші та маси спирту:
m(СnH2n+1COOH) = 13,8 г – 11,5 г = 2,3 г
7. Визначаємо молярну масу органічної кислоти:

8. Обчислюємо кількість атомів Карбону в органічній кислоті:
 = 12n+2n +46 = 46
= 12n+2n +46 = 46
Висновок: вуглеводневий радикал у формулі даної органічної кислоти замінено містить тільки один атом Гідрогену. Отже, формула органічної кислоти НСООН
Відповідь: Формула одноосновної органічної кислоти НСООН (метанова або мурашина кислота)
Приклад
При кількісній міжмолекулярній дегідратації суміші двох одноатомних насичених спиртів невідомої будови виділилось 13,4 г води й утворилось 66г суміші трьох органічних речовин з однаковими кількостями речовин. Відомо, що речовини належать до одного й того ж класу органічних сполук. Визначте склад вихідних спиртів.
 Дано: Розв’язування:
Дано: Розв’язування:
mсум.(3 етерів) = 66г 1) Складаємо рівняння реакції дегідратації суміші 2-х m(H2O) = 13,5г одноатомних спиртів:

 R-OH + R´ - OH R-O-R´ + H2O
R-OH + R´ - OH R-O-R´ + H2O
Склад вихідних
спиртів -? 2) Знаходимо кількість речовини Н2О:

За рівнянням υ (Н2О) = υ(R-O-R ´ )
υ(R-O-R´) = 0,75 моль
3) Визначаємо молярну масу суміші вуглеводневих радикалів, що входять до складу етерів:
M(R-O-R´)  г/моль
г/моль
M(R;R´) =M(R-O-R´) – M(O) = 88 – 16 = 72 г/моль
4) Виводимо вираз для визначення сумарної кількості атомів Карбону у продуктах реакції:
R = CnH2n+1
M(CnH2n+1) = 72 г/моль
12n + 2n + 2 = 72
14n = 70
n = 5
Отже, загальна кількість атомів Карбону у суміші вихідних спиртів 5.
Відповідь:
 1 суміш С2Н5ОН – етанол
1 суміш С2Н5ОН – етанол
С3Н7ОН – пропанол
 2 суміш СН3ОН - метанол
2 суміш СН3ОН - метанол
С4Н9ОН – бутанол
 3 суміш СН3ОН - метанол
3 суміш СН3ОН - метанол
С4Н9ОН – ізобутанол
Список використаної літератури
1. Березан О.В. Органічна хімія: навч. посіб. – Тернопіль: Підручники і посібники, 2012. – 208 с.
2. Боєчко Ф.Ф, та ін..Органічна хімія: Проб. підруч. для 10-11 класів (шкіл) хімічних профілів та класів (шкіл) з поглибленим вивченням предмета – К.: Вища шк., 2001. – 398 с.
3. Данильченко В.Є. Як розв’язувати задачі з хімії. 8 – 11 класи. – Х., 2008.
4. Дерибас М.В. Розв’язування розрахункових задач з хімії ускладненого типу алгебраїчним та графічним способами. // Біологія та хімія в школі. – 2/1998.
5. Зелена Р.М. Навчання учнів розв’язування розрахункових задач. // Шкільний світ. Хімія. – №№ 34 – 35/ 2004.
6. Інновації на уроках хімії. – Х., Основа, 2007.
7. Косинський О.І. Органічна хімія. Практикум: Посібник - Київ.: Вища школа, 2002 р
8. Кузьменко М.Є., Єрьомін В.В. Хімія. 2400 для школярів та абітурієнтів / Пер. з рос. – Тернопіль: Навчальна книга – Богдан, 2001. – 560 с.
9. Педагогічні знахідки на уроках хімії. – Х., Основа, 2007.
10. Сльота Л.О., Граніна Г.М., Холін В.Ю. Цікава хімія для вчителів і учнів. Харків. Видавнича група „Основа”.
11. Туринська Н.М. Основи загальної хімії. - Київ: Ірпінь: ВТФ "Перун".
12. Хомченко Г.П. Посібник з хімії для вступників. - Видавництво Київ "Н.С.К." 2000 р.
13. Ярошенко О. Г., Новицька В. І. Збірник задач і вправ з хімії—К., 1996.
Не нашли, что искали? Воспользуйтесь поиском: