
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
ЛЕКЦИЯ 5 Агрегатные состояния воды и фазовые переходы.
Состояния воды.
Вода может находиться в трех агрегатных состояниях, или фазах,— твердом (лед), жидком (собственно вода), газообразном (водяной пар). Очень важно, что при реально существующих на Земле диапазонах атмосферного давления и температуры вода может находиться одновременно в разных агрегатных состояниях. В этом отношении вода существенно отличается от других физических веществ, находящихся в естественных условиях преимущественно либо в твердом (минералы, металлы), либо в газообразном (О2, N2, СО2 и т.д.) состоянии.
Изменения агрегатного состояния вещества называют фазовыми переходами. В этих случаях свойства вещества (например, плотность) скачкообразно изменяются. Фазовые переходы сопровождаются выделением или поглощением энергии, называемой теплотой фазового перехода («скрытой теплотой»).
Зависимость агрегатного состояния воды от давления и температуры выражается диаграммой состояния воды, или фазовой диаграммой (рис. 5.1.1.).
Кривая ВВ'О на рис 5.1.1. носит название кривой плавления. При переходе через эту кривую слева направо происходит плавление

Рис. 5.1.1. Диаграмма состояния воды
I – VIII - различные модификации льда
льда, а справа налево — ледообразование (кристаллизация воды). Кривая ОК называется кривой парообразования. При переходе через эту кривую слева направо наблюдается кипение воды, а справа налево — конденсация водяного пара. Кривая АО носит название кривой сублимации, или кривой возгонки. При пересечении ее слева направо происходит испарение льда (возгонка), а справа налево — конденсация в твердую фазу (или сублимация).
В точке О (так называемой тройной точке, при давлении 610 Па и температуре 0,01° С или 273,16 К) вода одновременно находится во всех трех агрегатных состояниях.
Температура, при которой происходит плавление льда (или кристаллизация воды), называется температурой или точкой плавления Тпл. Эту температуру можно называть также температурой или точкой замерзания Тзам.
С поверхности воды, а также льда и снега постоянно отрывается и уносится в воздух некоторое количество молекул, образующих молекулы водяного пара. Одновременно с этим часть молекул водяного пара возвращается обратно на поверхность воды, снега и льда. Если преобладает первый процесс, то идет испарение воды, если второй — конденсация водяного пара. Регулятором направленности и интенсивности этих процессов служит дефицит влажности — разность упругости водяного пара, насыщающего пространство при данных давлении воздуха и температуре поверхности воды (снега, льда), и упругости фактически содержащегося в воздухе водяного пара, т.е. абсолютной влажности воздуха. Содержание в воздухе насыщенного водяного пара и его упругость увеличиваются с ростом температуры (при нормальном давлении) следующим образом. При температуре О°С содержание и упругость насыщенного водяного пара равны соответственно 4,856 г/м3 и 6,1078 гПа, при температуре 20°С — 30,380 г/м3 и 23,373 гПа, при 40°С — 51,127 г/м3 и 73,777 гПа.
Испарение с поверхности воды (льда, снега), а также влажной почвы идет при любой температуре и тем интенсивнее, чем больше дефицит влажности. С ростом температуры упругость водяного пара, насыщающего пространство, растет, и испарение ускоряется. К увеличению испарения приводит и возрастание скорости движения воздуха над испаряющей поверхностью (т.е. скорости ветра в природных условиях), усиливающее интенсивность вертикального массо- и теплообмена.
Когда интенсивное испарение охватывает не только свободную поверхность воды, но и ее толщу, где испарение идет с внутренней поверхности образующихся при этом пузырьков, начинается процесс кипения. Температура, при которой давление насыщенного водяного пара равно внешнему давлению, называется температурой или точкой кипения Tкип.
При нормальном атмосферном давлении (1,013•105 Па = 1,013 бар = 1 атм = 760 мм рт. ст.) точки замерзания воды (плавления льда) и кипения (конденсации) соответствуют по шкале Цельсия 0 и 100°.
Температура замерзания Тзам и температура кипения воды Ткип зависят от давления (см. рис. 3.9.2.). В диапазоне изменения давления от 610 до 1,013•105 Па (или 1 атм) температура замерзания немного понижается (от 0,01 до 0° С), затем при росте давления приблизительно до 6•107 Па (600 атм) Тзам падает до —5° С, при увеличении давления до 2,2•108 Па (2 200 атм) Тзам уменьшается до —22° С. При дальнейшем увеличении давления Тзам начинает быстро возрастать. При очень большом давлении образуются особые «модификации» льда (II—VIII), отличающиеся по своим свойствам от обычного льда (льда I).
При реальном атмосферном давлении на Земле пресная вода замерзает при температуре около 0° С. На максимальных глубинах в океане (около 11 км) давление превышает 108 Па, или 1 000 атм (увеличение глубины на каждые 10 м увеличивает давление приблизительно на 105 Па, или 1 атм). При таком давлении температура замерзания пресной воды была бы около —12° С.
На снижение температуры замерзания воды
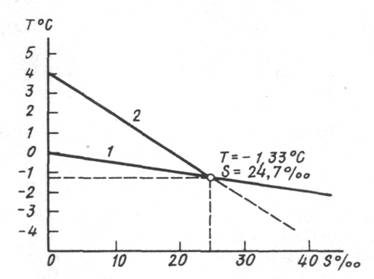
Рис. 5.1.2.
оказывает влияние ее соленость.
1.4). Увеличение солености на каждые 10‰ снижает Тзам приблизительно на 0,54° С:
Тзам = -0,054 S.
Температура кипения с уменьшением давления снижается (см. рис. 3.9.2.). Поэтому на больших высотах в горах вода кипит при температуре ниже, чем 100° С. При росте давления Ткип возрастает до так называемой «критической точки», когда при р = 2,2 • 107 Па и Ткип = 374° С вода одновременно имеет свойства и жидкости и газа.
Диаграмма состояния воды иллюстрирует две «аномалии» воды, оказывающие решающее влияние не только на «поведение» воды на Земле, но и на природные условия планеты в целом. По сравнению с веществами, представляющими собой соединения водорода с элементами, находящимися в Периодической таблице Менделеева в одном ряду с кислородом,— теллуром Те, селеном Se и серой S, температура замерзания и кипения воды необычно высока. Учитывая закономерную связь температуры замерзания и кипения с массовым числом упомянутых веществ, следовало бы ожидать у воды значения температуры замерзания около —90° С, а температуры кипения около —70° С. Аномально высокие значения температуры замерзания и кипения предопределяют возможность существования воды на планете как в твердом, так и в жидком состоянии и служат определяющими условиями основных гидрологических и других природных процессов на Земле.
Плотность воды
Плотность — главнейшая физическая характеристика любого вещества. Она представляет собой массу однородного вещества, приходящуюся на единицу его объема:
р = m/V,
где m — масса, V — объем. Плотность р имеет размерность кг/м3.
Плотность воды, как и других веществ, зависит прежде всего от температуры и давления (а для природных вод — еще и от содержания растворенных и тонкодисперсных взвешенных веществ) и скачкообразно изменяется при фазовых переходах.. При повышении температуры плотность воды, как и любого другого вещества, в большей части диапазона изменения температуры уменьшается, что связано с увеличением расстояния между молекулами при росте температуры. Эта закономерность нарушается лишь при плавлении льда и при нагревании воды в диапазоне от 0 до 4° (точнее 3,98° С). Здесь отмечаются еще две очень важные «анатомии» воды: 1) плотность воды в твердом состоянии (лед) меньше, чем в жидком (вода), чего нет у подавляющего большинства других веществ; 2) в диапазоне температуры воды от 0 до 4° С плотность воды с повышением температуры не уменьшается, а увеличивается. Особенности изменения плотности воды связаны с перестройкой молекулярной структуры воды. Эти две «аномалии» воды имеют огромное гидрологическое значение: лед легче воды и поэтому «плавает» на ее поверхности; водоемы обычно не промерзают до дна, так как охлажденная до температуры ниже 4° пресная вода становится менее плотной и поэтому остается в поверхностном слое.
Плотность льда зависит от его структуры и температуры. Пористый лед может иметь плотность, намного меньшую, чем указано в таблице1.1. Еще меньше плотность снега. Свежевыпавший снег имеет плотность 80—140 кг/м3,плотность слежавшегося снега постепенно увеличивается от 140—300 (до начала таяния) до 240—350 (в начале таяния) и 300—450 кг/м3 (в конце таяния). Плотный мокрый снег может иметь плотность до 600—700 кг/м3. Снежинки во время таяния имеют плотность 400—600, лавинный снег 500—650 кг/м3. Слой воды, образующийся при таянии льда и снега, зависит от толщины слоя льда или снега и их плотности. Запас воды в льде или в снеге равен:
hв = ahлрл/р
где hл — толщина слоя льда или снега, рл — их плотность, р — плотность воды, а — множитель, определяемый соотношением размерностей hв и hл: если слой воды выражается в мм, а толщина льда (снега) в см, то а=10, при одинаковой размерности а=1.
Плотность воды изменяется также в зависимости от содержания в ней растворенных веществ и увеличивается с ростом солености (рис. 1.5). Плотность морской воды при нормальном давлении может достигать 1025—1033 кг/м3.
Совместное влияние температуры и солености на плотность воды при атмосферном давлении выражают с помощью так называемого уравнения состояния морской воды. Такое уравнение в самом простом линейном виде записывают следующим образом:
р = ро(1 — α1Т + α2S)
где Т — температура воды, °С, S — соленость воды, ‰, ро — плотность воды при Т = 0 и S = 0, α1 и α2 — параметры.
Увеличение солености приводит также к понижению температуры наибольшей плотности (°С) согласно формуле
Тнаиб.пл = 4 - 0,215 S.

Рис. 5.2.1. Зависимость плотности воды при нормальном атмосферном давлении от температуры и солености воды.
Увеличение солености на каждые 10‰ снижает Тнаиб.пл приблизительно на 2° С. Зависимость температуры наибольшей плотности и температуры замерзания от солености воды иллюстрирует так называемый график Хелланд-Хансена (см. рис. 3.10.1.).
Соотношения между температурами наибольшей плотности и замерзания влияют на характер процесса охлаждения воды и вертикальной конвекции — перемешивания, обусловленного различиями в плотности. Охлаждение воды в результате теплообмена с воздухом приводит к увеличению плотности воды и, соответственно, к опусканию более плотной воды вниз. На ее место поднимаются более теплые и менее плотные воды. Происходит процесс вертикальной плотностной конвекции. Однако для пресных и солоноватых вод, имеющих соленость менее 24,7‰, такой процесс продолжается лишь до момента достижения водой температуры наибольшей плотности (см. рис. 1.4). Дальнейшее охлаждение воды ведет к уменьшению ее плотности, и вертикальная конвекция прекращается. Соленые воды при S>24,7‰ подвержены вертикальной конвекции вплоть до момента их замерзания.
Таким образом, в пресных или солоноватых водах зимой в придонных горизонтах температура воды оказывается выше, чем на поверхности, и, согласно графику Хелланд-Хансена, всегда выше температуры замерзания. Это обстоятельство имеет огромное значение для сохранения жизни в водоемах на глубинах. Если бы у воды температуры наибольшей плотности и замерзания совпадали бы, как у всех других жидкостей, то водоемы могли промерзать до дна, вызывая неизбежную гибель большинства организмов.
«Аномальное» изменение плотности воды при изменении температуры влечет за собой такое же «аномальное» изменение объема воды: с возрастанием температуры от 0 до 4° С объем химически чистой воды уменьшается, и лишь при дальнейшем повышении температуры — увеличивается; объем льда всегда заметно больше объема той же массы воды (вспомним, как лопаются трубы при замерзании воды).
Изменение объема воды при изменении ее температуры может быть выражено формулой
VT1 = VT2(1 + β DT)
где VT1 — объем воды при температуре Т1, VT2 — объем воды при T2, β — коэффициент объемного расширения, принимающий отрицательные значения при температуре от 0 до 4° С и положительные при температуре воды больше 4° С и меньше 0° С (лед) (см. табл. 1.1),
DT =T2 -T1.
Некоторое влияние на плотность воды оказывает также и давление. Сжимаемость воды очень мала, но она на больших глубинах в океане все же сказывается на плотности воды. На каждые 1000 м глубины плотность вследствие влияния давления столба воды возрастает на 4,5—4,9 кг/м3. Поэтому на максимальных океанских глубинах (около 11 км) плотность воды будет приблизительно на 48 кг/м3 больше, чем на поверхности, и при S = 35‰ составит около 1076 кг/м3. Если бы вода была совершенно несжимаемой, уровень Мирового океана был бы на 30 м выше, чем в действительности. Малая сжимаемость воды позволяет существенно упростить гидродинамический анализ движения природных вод.
Влияние мелких взвешенных наносов на физические характеристики воды и, в частности, на ее плотность изучено еще недостаточно. Считают, что на плотность воды могут оказывать влияние лишь очень мелкие взвеси при их исключительно большой концентрации, когда воду и наносы уже нельзя рассматривать изолированно. Так, некоторые виды селей, содержащие лишь 20—30% воды, представляют собой по существу глинистый раствор с повышенной плотностью. Другим примером влияния мелких наносов на плотность могут служить воды Хуанхэ, втекающие в залив Желтого моря. При очень большом содержании мелких наносов (до 220 кг/м3) речные мутные воды имеют плотность на 2—2,5 кг/м3 больше, чем морские воды (их плотность при фактической солености и температуре около 1018 кг/м3). Поэтому они «ныряют» на глубину и опускаются по морскому дну, формируя «плотный», или «мутьевой», поток.
Не нашли, что искали? Воспользуйтесь поиском: