
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Квантовые числа. Спектры атома водорода
Базируясь на постулатах Бора, рассчитаем частоты спектров испускания атома водорода. При движении электрона вокруг ядра по круговой орбите в роли центростремительной силы должна выступать сила Кулона:
 , (4 – 3)
, (4 – 3)
где 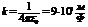 . Исключив из уравнений (4 – 1) и (4 – 3) скорость движения электрона
. Исключив из уравнений (4 – 1) и (4 – 3) скорость движения электрона  , получим формулу радиусов стационарных орбит для атома водорода:
, получим формулу радиусов стационарных орбит для атома водорода:
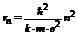 (4 – 4)
(4 – 4)
Из формулы (4 – 4) следует, что радиусы устойчивых орбит пропорциональны квадрату номера стационарной орбиты. Радиус первой боровской орбиты по формуле (4 – 4) равен  , что хорошо совпадает с экспериментальными данными.
, что хорошо совпадает с экспериментальными данными.
Определим энергию электронов на стационарных орбитах. В энергию электрона необходимо включить кинетическую составляющую и потенциальную энергию взаимодействия электрона с ядром:
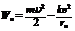 . (4 – 5)
. (4 – 5)
Выразив скорость электрона из формулы (4 – 3) и взяв для радиуса выражение (4 – 4), получим формулу энергии электрона в атоме на  – уровне:
– уровне:
 . (4 – 6)
. (4 – 6)
Из полученной формулы следует, что энергия электрона в атоме определяется номером стационарной орбиты. Число  получило название главного (энергетического) квантового числа. Так как атом излучает или поглощает энергию только при переходе электрона с одного стационарного энергетического уровня на другой, энергию фотона, излученного атомом водорода, можно выразить разностью энергии электрона этих уровней:
получило название главного (энергетического) квантового числа. Так как атом излучает или поглощает энергию только при переходе электрона с одного стационарного энергетического уровня на другой, энергию фотона, излученного атомом водорода, можно выразить разностью энергии электрона этих уровней:
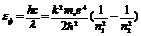 (4 – 7)
(4 – 7)
Из формулы (4 – 7) получаем закон длин волн для каждой серии спектра водорода:
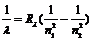 (4 – 8)
(4 – 8)
и формулу частоты фотона испущенного атомом:
 , (4 – 9)
, (4 – 9)
где постоянные Ридберга соответственно равны:  и
и 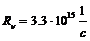 . Формула (4 – 9) совпала с обобщенной формулой Бальмера, полученной им при исследовании спектра атома водорода.
. Формула (4 – 9) совпала с обобщенной формулой Бальмера, полученной им при исследовании спектра атома водорода.
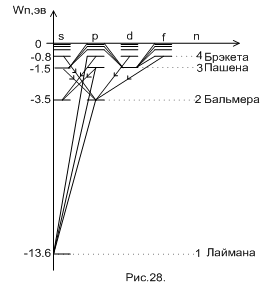
На рис.28 схематично показана энергетическая структура состояний атома водорода по модели Бора. Дополнительно учтены состояния, определяемые азимутальным квантовым числом ℓ, принимающим значения: ℓ = 0, 1, 2, 3 …, 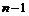 . При
. При 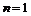 число ℓ принимает единственное значение ℓ = 0. Электрон, находящийся в состоянии ℓ = 0, назвали s – электроном (s – состояние). При
число ℓ принимает единственное значение ℓ = 0. Электрон, находящийся в состоянии ℓ = 0, назвали s – электроном (s – состояние). При  число ℓ принимает значения 0 и 1. Состояние с ℓ =1 назвали р – состоянием и т.д. На рисунке частично показаны переходы электронов для серии Лаймана (на
число ℓ принимает значения 0 и 1. Состояние с ℓ =1 назвали р – состоянием и т.д. На рисунке частично показаны переходы электронов для серии Лаймана (на 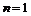 ), Бальмера (на
), Бальмера (на  ) и Пашена (на
) и Пашена (на 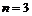 ) с соблюдением условий допустимости таких переходов:
) с соблюдением условий допустимости таких переходов:
Δℓ = ±1. (4 – 10)
Согласно квантовой механике состояние каждого электрона в атоме должно определяться четырьмя квантовыми числами:
главным  (
(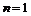 ,2,…), азимутальным ℓ (ℓ = 0, 1,…
,2,…), азимутальным ℓ (ℓ = 0, 1,… 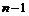 ), магнитным
), магнитным  (
( = -ℓ,…-1, 0,+1…+ℓ), спиновым
= -ℓ,…-1, 0,+1…+ℓ), спиновым 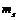 (
(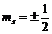 ).
).
Энергия состояния электрона в атоме зависит от чисел  и ℓ. В невозбужденном состоянии атома его электроны должны находиться на самых низких доступных для них энергетических уровнях, определяемых принципом Паули (законом квантовой механики): в атоме не может находиться более одного электрона, с одинаковым набором квантовых чисел
и ℓ. В невозбужденном состоянии атома его электроны должны находиться на самых низких доступных для них энергетических уровнях, определяемых принципом Паули (законом квантовой механики): в атоме не может находиться более одного электрона, с одинаковым набором квантовых чисел  , ℓ,
, ℓ,  и
и 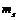 .
.
В состоянии с конкретным значением уровня n максимальное количество электронов не должно превышать число 2 n 2. В соответствии со значениями главного квантового числа  =1, 2, 3, 4,… оболочки электронов стали обозначать буквами K; L; M; N…
=1, 2, 3, 4,… оболочки электронов стали обозначать буквами K; L; M; N…
Не нашли, что искали? Воспользуйтесь поиском: