
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Химический состав мышечной ткани
В составе мышечной ткани содержатся (в %): вода — 70— 75, белки—18—22, ферменты липиды — 2—3, азотистые экстрактивные вещества — 1 —1,7, безазотистые экстрактивные вещества — 0,7—1,35, неорганические соли—1 —1,5, углеводы-0,5—3, а также витамины.
Белковые вещества мышечной ткани. Белковые вещества составляют 60—80 % сухого остатка мышечной ткани, или 18-22 % массы ткани. Белки мышечной ткани являются «строительным материалом». Из них построены различные структурные компоненты клеток (саркоплазма, сарколемма, миофибриллы, органеллы) и межклеточного вещества. Кроме этого, ряд белков мышечной ткани обладает ферментативными свойствами.
Белки мышечной ткани можно подразделить на растворимые в воде (белки саркоплазмы), растворимые в солевых растворах (белки миофибрилл) и нерастворимые в водно-солевых растворах, условно называемые белками стромы. Фракция стромы включает белки, входящие в состав сарколеммы и внутримышечной соединительной ткани, а также белки ядер.
Белки саркоплазмы составляют около 20—25% всех мышечных белков. К ним относятся миоген, миоальбумин, глобулин X и миоглобин. За исключением миоглобина, это сложные смеси белковых веществ, близких по физико-химическим и биологическим свойствам. Например, характеризуя белок саркоплазмы миоген, мы имеем в виду не отдельный белок, а миогеновую фракцию — ряд сходных белков-миогенов (миогены А, В, С).
По физико-химическим свойствам (растворимости и высаливаемости) миоген довольно близок к альбуминам; миоальбумин является типичным альбумином. Глобулин X является псевдоглобулином, так как для растворения его достаточно незначительной концентрации солей. Наличие небольшого количества неорганических солей (1 —1,5%) в самой мышечной ткани оказывается достаточным, чтобы при извлечении водой глобулин X перешел в раствор. Миоглобин также является водорастворимым белком. Таким образом, белки саркоплазмы являются в основном водорастворимыми.
Миоген, миоальбумин и глобулин X относятся к простым белкам. Это белки полноценные и хорошо усвояемые. Их изоэлектрические точки находятся в кислой среде. У миогеновой фракции рН 6,0—6,7, у миоальбумина рН 3—3,5, у глобулина X рН 5,2.
Ряд белков миогеновой фракции обладает ферментативной активностью; они катализируют процессы гликолиза.
Важным белковым компонентом саркоплазмы является миоглобин— дыхательный пигмент мышечной ткани, окрашивающий ее в красный цвет. Миоглобин (Mb) —это сложный белок из класса хромопротеидов. Его молекула состоит из белка глобина и простетической группы — тема (см. рис. 11). Миоглобины различных животных различаются по белковой части-глобину. Строение гема у различных животных одинаково. Миоглобин—белок с небольшой молекулярной массой (16800). Молекула его состоит из одной полипептидной цепи, полная аминокислотная последовательность которой в настоящее время расшифрована.
Гем является производным класса порфинов — соединений, в структуре которых содержится четыре пиррольных кольца, связанных между собой метиновыми группами (—СН =):

Порфин
Порфины различаются по природе групп, находящихся в боковых цепях. В теме порфин находится в форме протопорфирина, представляющего собой порфин, в молекуле которого введены боковые цепочки — четыре метильные (СН3), две винильные (—СН=СН3) и два остатка пропионовой кислоты (СН2—СН2—СООН).
В теме содержится один из изомеров протопорфиринов—протопорфирин

Порфирины могут присоединять ноны металлов. Биологические наиболее важны металлопорфирины, которые содержат железо или магний.
Комплекс протопорфирина IX с атомом Fe (II) называется гемом.

В этом соединении ион железа замещает диссоциирующие атомы водорода двух пиррольных колец (см. формулу порфирина) и одновременно связывается координационными связями с атомами азота двух других колец.
Миоглобин легко соединяется с некоторыми газами (С>2, СО, NO и др.), не изменяя при этом валентности железа. Так образуются производные миоглобина: оксимиоглобин (МЬО2) ало-красного цвета, карбоксимиоглобин (МЬСО) вишнево-красного цвета; нитрозомиоглобин (MbNO) красного цвета.
При действии сильных окислителей (длительное воздействие кислорода, перекиси водорода и др.) железо тема, теряя один электрон, переходит в трехвалентное состояние. Комплексное соединение протопорфирина IX с Fe (III) носит название геми н а, или гематина. Вследствие такого окисления миоглобин переходит в метмиоглобин (ММЬ)—пигмент коричневого цвета. Метмиоглобин может быть восстановлен в миоглобин только под действием сильных восстановителей, например аскорбиновой кислоты.
При взаимодействии миоглобина с сероводородом в присутствии кислорода образуется сульфомиоглобин — пигмент зеленого цвета. Гем может окисляться не только вследствие окисления железа, но и порфиринового кольца с образованием зеленых пигментов — сульфомиоглобина и холеоглобина, а при дальнейшем окислении кольца образуются вещества с разной окраской — от желтой до светлой. Поваренная соль ускоряет эти процессы, поэтому при посоле мышечная ткань теряет свою естественную окраску и приобретает серо-коричневую с различными оттенками.
Несмотря на небольшое содержание в мышечных клетках (около 1 % всех белков ткани), миоглобин играет важную роль в передаче кислорода, поставляемого кровью, клеткам мышечной ткани. Кроме того, миоглобин выполняет роль кислород-
ного резерва. Это свойство белка имеет важное значение. Таким образом запасается кислород в мышечных клетках на случай всякого рода переборов в снабжении, например на случай длительного погружения под воду.
В связи с тем что мышечная ткань снабжается кислородом посредством миоглобина, в усиленно работающих мышцах миоглобина содержится больше, так как в них окисление протекает интенсивнее. Известно, что мышцы ног сильнее окрашены, чем спинная мышца. Особенно это заметно у домашних птиц, грудные мышцы которых, являясь нерабочими, почти не окрашены.
Миоглобин — полноценный белок. Изоэлектрическая точка его лежит при рН 7,0.
Белки миофибрилл — миозин, актин, актомиозин, тропомиозин и некоторые другие — являются сократительными белками мышц. Они составляют около 80 % общего белка мышц.
Миозин, на долю которого приходится около 40 % всех белков мышечной ткани, относится к фибриллярным белкам благодаря вытянутой форме своих молекул. Молекула его представляет собой длинную фибриллярную нить с глобулярной «головкой» и построена из четырех полипептидных цепей - двух больших и двух малых. Как видно из рис. 45, две большие
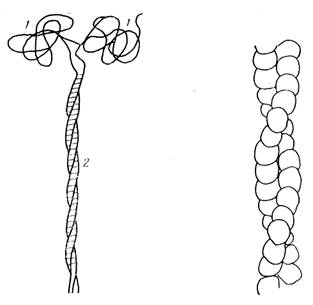
Рис. 45. Строение молекулы миозина: Рис. 46. Строение двойной спирали
/ — глобулярная «головка»; Г-актина
2 — фибриллярный «хвост»
полипептидные цепи, каждая из которых свернута в а-спираль, закручены относительно друг друга, образуя двойную спираль. На одном конце молекулы миозина две более короткие полипептидные цепочки, присоединяясь, как бы продолжают эту нить, но не связываются в общую спираль, а находятся в свободном состоянии, образуя шарообразное утолщение, своего рода «головку». В структуре молекулы миозина имеются, таким образом, четыре субъединицы, в результате объединения которых образуется четвертичная структура миозина.
Миозин получен в кристаллическом виде. Молекулярная масса его 470 000. По растворимости и высаливаемости он ведет себя как типичный глобулин. Около 30 % всех аминокислот миозина приходится на долю дикарбоновых кислот, что придает белку кислый характер. Изоэлектрическая точка его находится при рН 5,4.
Большое количество полярных групп, а также фибриллярная форма молекул обусловливают значительную гидратацию миозина — способность удерживать большое количество воды.
Молекулы миозина легко соединяются друг с другом, с другими белками, в частности с актином с образованием актомиозина. Кроме того, миозин взаимодействует с другими компонентами клетки — гликогеном, АТФ, липидами.
Он выполняет не только пластическую функцию, участвуя в построении миофибрилл мышечных клеток, но и обладает ферментативными свойствами. Советские ученые В. А. Энгельгардт и М. Н. Любимова доказали наличие у миозина способности катализировать гидролитический распад АТФ по следующей реакции:
Миозин
АТФ + Н2О----- --+ АДФ + Н2РО4 + Q (энергия).
Следовательно, миозин является ферментом аденозинтрифосфатазы. Ферментативная активность чистого миозина проявляется в присутствии ионов Са. В расслабленных мышцах миозин находится в комплексе с Mg и АТФ. Мышца находится в эластическом состоянии. Удаление АТФ из комплекса, например, путем отмывания, вызывает потерю эластичности. Миозин — белок полноценный и хорошо усвояемый.
Актин составляет 12—15 % всех мышечных белков. Он существует в двух формах — глобулярной (Г-актин) и фибриллярной (Ф-актин), резко различающихся по своим физико-химическим свойствам. Эти две формы могут переходить одна в другую. Молекулы Г-актина шаровидные с молекулярной массой 47 000. Г-актин может полимеризоваться с образованием Ф-актина. Такая агрегация зависит от небольшого изменения в солевом составе среды и рН. Полимеризация ускоряется в присутствии АТФ. При удалении солей, например, при диализе происходит обратное явление:

Нить Ф-актина состоит из двух Г-актиновых цепей, образующих двойную спираль (рис. 46). Каждая спираль — это цепочка, состоящая из 200—300 отдельных глобул-бусинок. Молекулярная масса Ф-актина до 1500000. Актин не обладает АТФ-азной активностью, относится к полноценным и хорошо усвояемым белкам.
Актомиозин, — это комплекс, состоящий из двух белков актина и миозина. При образовании актомиозина молекулы миозина прикрепляются своими головками к бусинкам актина через SH-группы миозина и ОН-группы актина. Поскольку цепь Ф-актина содержит много молекул Г-актина, каждая нить Ф-актина может связывать большое число молекул миозина. Важным свойством актомиозинового комплекса является его способность диссоциировать в присутствии АТФ и Mg4-4-. Актомиозин как подлинный глобулин нерастворим в воде. Раствор актомиозина отличается высокой вязкостью. Степень вязкости растворов актомиозина зависит от соотношения в них актина и миозина: чем больше содержится актина, тем выше вязкость. Молекулярная масса актомиозина колеблется в широких пределах, так как соотношение актина и миозина в актомиозиновом комплексе может быть различным.
Тропомиозин составляет 10—12 % всех белков миофибрилл или 2,5 % белков мышц. Тропомиозин растворим в воде, но из мышечной ткани водой не извлекается, что свидетельствует о связи его с нерастворимыми в воде белками миофибрилл. Тропомиозин — это фибриллярный белок, имеет форму сильно вытянутых палочек. Он состоит из двух сходных полипептидных цепей, которые образуют двойную спираль. Тропомиозин образует комплекс с Ф-актином, участвует в мышечном сокращении. Тропомиозин — белок неполноценный, он не содержит триптофана. Изоэлектрическая точка его 5,1, молекулярная масса 130000.
В миофибриллах обнаружено небольшое количество других белков (тропонин, актинин и др.)> которые также участвуют в мышечном сокращении.
Белки стромы входят в состав сарколеммы и рыхлой соединительной ткани, объединяющей мышечные волокна в пучки и белки ядер. Эти белки не растворяются в водно-солевых растворах. К ним относятся соединительнотканные белки: коллаген, эластин и ретикулин и гликопротеиды — муцины и мукоиды. Последние представляют собой слизистые белки, выполняющие защитные функции и облегчающие скольжение мышечных пучков. Эти белки извлекаются щелочными растворами.
В ядрах мышечных клеток содержатся, по крайней мере, три белковые фракции: нуклеопротеиды, кислый белок и остаточный белок. Ядро мышечных клеток построено главным образом из нуклеопротеидов. Простетической группой этих сложных белков является дезоксирибонуклеиновая кислота, белковыми компонентами нуклеопротеидов — гистоны. Это неполноценные белки — в них нет триптофана. Нуклеопротеиды растворяются в щелочах. «Кислый белок» также растворяется в щелочах. В отличие от гистонов в молекуле «кислого белка» содержится триптофан. После удаления нуклеопротеидов и «кислого белка» в ядрах остается желеобразная масса — остаточный белок, по свойствам и аминокислотному составу похожий на коллаген.
Ферменты мышечной ткани. Мышечная ткань характеризуется большим разнообразием содержащихся в ней ферментов, ибо мышечная ткань является одной из самых «работающих» тканей. Это прежде всего ферментная система, связанная с прижизненной функцией мышц —функцией движения. Эта ферментная система управляет актом сокращения и расслабления мышечных волокон. Она включает в себя как ферменты, связанные с сокращением миофибрилл и распадом АТФ — вещества, непосредственно поставляющего энергию сокращающимся миофибриллам, так и совокупность ферментов, обеспечивающих получение большого количества энергии в форме АТФ, необходимой для мышечной деятельности. Это ферменты гликолиза, а также ферменты цикла трикарбоновых кислот и дыхательной цепи.
После углеводов жиры являются важнейшим источником энергии в мышцах. При недостатке углеводов в процесс обмена вовлекается большое количество жира. В мышцах присутствуют ферменты, окисляющие жирные кислоты. Непосредственно с этими ферментными системами связаны и ферментные системы, обусловливающие распад и синтез главных структурных элементов мышечной ткани: ферменты, принимающие участие в синтезе белка на рибосомах, обмене аминокислот и др. Таким образом, в мышечной ткани содержатся сложные ферментные системы, составляющие единый комплекс.
Особо следует остановиться на ферментах, которые содержатся в лизосомах. Это гидролазы, способные гидролизовать высокомолекулярные компоненты клеток — белки, полисахариды, липиды и нуклеиновые кислоты. В неповрежденных клетках эти ферменты надежно удерживаются липопротеидной мембраной внутри лизосом. Если целостность лизосомы нарушена, то гидролазы высвобождаются и переваривают компоненты клетки, как это имеет место, например, после смерти животного на поздних стадиях автолиза.
Липиды. Липиды мышечной ткани представлены жирами, фосфолипидами, а из стеридов— свободным и связанным холестерином. Липиды, входящие в состав мышечной ткани, выполняют функции двоякого рода. Часть их, главным образом фосфолипиды, является пластическим материалом. Фосфолипиды входят в состав митохондрий, миофибрилл, клеточных мембран. Другая часть липидов выполняет роль резервного энергетического материала. Такие липиды, главным образом жиры, содержатся в саркоплазме мышечного волокна в виде мельчайших капелек, придавая ей мутный вид. В большом количестве липиды содержатся в межклеточных пространствах, между пучками мышц в соединительнотканных прослойках. Общее содержание липидов в мышечной ткани, а также их компонентов колеблется в широких пределах и зависит от упитанности животного, вида, возраста, пола и т. д.
Углеводы. Содержание углеводов в мышечной ткани сравнительно невелико. Они представлены главным образом гликогеном и глюкозой. Содержание гликогена в мышцах зависит от тренированности и упитанности животного: в мышцах плохо откормленных, истощенных, голодных и больных животных его в 2—3 раза меньше, чем в мышцах животных, находящихся в нормальном физиологическом состоянии. В разных мышцах содержание гликогена различно: в усиленно работающих мышцах его почти в 1,5 раза больше, чем в мышцах, мало работающих. В свежих мышцах убойных животных содержится 0,3— 0,9%, а иногда и 2% гликогена и 0,5,% глюкозы.
Минеральные вещества. В мышечной ткани присутствует большое количество минеральных веществ. В табл. 9 приведены обобщенные данные по содержанию элементов в мышечной ткани крупного рогатого скота.
Таблица 9
| Элемент | Содержание, мг% | Элемент | Содержание, мг% | ||
| Фосфор Калий Натрий Кальций Магний Железо Цинк Алюминий Медь | 2,7 3,4 0,5 0,11 | Марганец Кобальт Молибден Никель Свинец Хром Фтор Йод | 0,024 0,004 0,0075 0,008 0,008 0,011 0,03 0,014 |
Как видно из табл. 9, по сравнению с другими элементами особенно много в мышечной ткани содержится калия и фосфора. Значительная доля калия и кальция связана с белками. Взаимодействие калия, магния и кальция с актином, миозином и АТФ имеет важное значение в процессах сокращения и расслабления миофибрилл.
Витамины. В составе мышечной ткани имеются почти все водорастворимые витамины, но практически отсутствует витамин С. В липидпой части мышц содержится небольшое количество (0,02 мг%) витаминов А и D (0,0002 мг%). Для различных животных и разного их состояния количество витаминов неодинаково.
Экстрактивные вещества. При обработке мышечной ткани водой из нее экстрагируется ряд органических веществ, кроме белков и липидов. Поэтому их называют экстрактивным и. Различают азотистые и безазотистые экстрактивные вещества.
К безазотистым экстрактивным веществам относятся углеводы и продукты их обмена, витамины, органические фосфаты. Продуктами обмена углеводов являются глюкоза, мальтоза, молочная, пировиноградная, янтарная и другие органические кислоты. Из них в количественном отношении молочная кислота наиболее значительна. Количество других относительно невелико.
Азотсодержащие экстрактивные вещества — это вещества, содержащие азот, но не относящиеся к белкам. Среди них можно выделить конечные (мочевина, мочевая кислота, аммонийные соли) и промежуточные (пуриновые основания, аминокислоты и др.) продукты белкового обмена. Мышечная ткань содержит также ряд азотсодержащих веществ, которые при жизни животного выполняют специфические функции в процессе обмена веществ и энергии. К ним относятся карнозин, ансерин, креатин, креатинфосфат, аденозинтрифосфат и другие свободные нуклеотиды.
Современные представления об экстрактивных веществах мышечной ткани основываются на работах известного русского биохимика В. С. Гулевича. Им был выделен ряд специфических экстрактивных веществ из мышц человека и животных.
Карнозин представляет собой дипептид, состоящий из остатков β-аланина и гистидина:

Из мышечной ткани гусей был выделен гомолог карнозина — метилированный карнозин, который получил название ансерин. Он широко распространен и в мышцах других животных

При жизни животного эти дипептиды участвуют в процессах окислительного фосфорилирования, происходящего в мышцах при образовании макроэргических фосфатных соединений (аденозинтрифосфата и креатинфосфата). В скелетных мышцах убойных животных содержание карнозкна и ансерина колеблется в широких пределах (от 14 мг °/о до 1 %).
Глутатион — это специфический трипептид, состоящий из глутаминовой кислоты, цистеина и глицина:

Глутатион является сильным восстановителем и легко окисляется. В живых тканях он находится в основном в восстановленной форме и по мере надобности переходит в окисленную форму:
—2Н
2SH—Глутатион < S — S=Глутатион.
+2Н
Биологическая функция глутатиона до сих пор недостаточно выяснена. По-видимому, она сводится в основном к поддержанию на определенном уровне содержания биологически активных сульфгидрильных групп (SH) в белках клетки и активации ферментов, содержащих в активном центре SH-группы. В мышцах при жизни содержание глутатиона составляет 25,8— 41,5 мг%.
Креатин по своему строению является метилгуанидинуксусной кислотой:

При жизни животного свободного креатина в мышцах содержится сравнительно мало. 70—80 % его связано с фосфорной кислотой в макроэргическом соединении, называемом креатинфосфатом (КРФ):

В мышечных клетках КРФ образуется путем фосфорилирования креатина, т. е. присоединения к нему одной из фосфатных групп, отщепляемых от АТФ. Реакцию осуществляет фермент креатинфосфокиназа (КФК). Эта реакция обратима. КФК способна также расщеплять креатинфосфат и за его счет, фосфорилируя АДФ, восстанавливать в тканях АТФ: Креатин | АТФ Креатинфосфат | АДФ.
Креатинфосфат— богатое энергией соединение, выполняющее роль легко мобилизуемого резерва энергии. Кроме того, он выполняет функцию внутриклеточного транспорта энергии от митохондрий (место ее получения) к сократительным элементам— миофибриллам (место ее потребления в мышечных клетках). Во фракции экстрактивных веществ содержится 10— 11 % общего количества азота в свежей мышечной ткани.
После убоя животного экстрактивные вещества и продукты их превращения участвуют в создании специфического вкуса и аромата мяса.
Не нашли, что искали? Воспользуйтесь поиском: