
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Метод молекулярных орбиталей
Метод ВС широко используется химиками. В рамках этого метода большая и сложная молекула рассматривается как состоящая из отдельных двухцентровых и двухэлектронных связей. Принимается, что электроны, обусловливающие химическую связь, локализованы (расположены) между двумя атомами. К большинству молекул метод ВС может быть применен с успехом. Однако имеется ряд молекул, к которым этот метод неприменим или его выводы находятся в противоречии с опытом.
Установлено, что в ряде случаев определяющую роль в образовании химической связи играют не электронные пары, а отдельные электроны. На возможность химической связи при помощи одного электрона указывает существование иона H2+. При образовании этого иона из атома водорода и иона водорода выделяется энергия в 255 кДж. Таким образом, химическая связь в ионе H2+  довольно прочная.
довольно прочная.
Если попробовать описать химическую связь в молекуле кислорода по методу ВС, то придем к заключению, что, во-первых, она должна быть двойной (σ- и p-связи), во-вторых, в молекуле кислорода все электроны должны быть спарены, т.е. молекула О2 должна быть диамагнитна (у диамагнитных веществ атомы не обладают постоянным магнитным моментом и вещество выталкивается из магнитного поля). Парамагнитным веществом называется то, атомы которого или молекулы обладают магнитным моментом, и оно обладает свойством втягиваться в магнитное поле. Экспериментальные данные показывают, что по энергии связь в молекуле кислорода действительно двойная, но молекула является не диамагнитной, а парамагнитной. В ней имеется два неспаренных электрона. Метод ВС бессилен объяснить это факт.
Метод молекулярных орбиталей (МО) наиболее нагляден в его графической модели линейной комбинации атомных орбиталей (ЛКАО). Метод МО ЛКАО основан на следующих правилах.
1) При сближении атомов до расстояний химических связей из атомных орбиталей (АО) образуются молекулярные.
2) Число полученных молекулярных орбиталей равно числу исходных атомных.
3) Перекрываются атомные орбитали, близкие по энергии. В результате перекрывания двух атомных орбиталей образуются две молекулярные. Одна из них имеет меньшую энергию по сравнению с исходными атомными и называется связывающей, а вторая молекулярная орбиталь обладает большей энергией, чем исходные атомные орбитали, и называется разрыхляющей.
4) При перекрывании атомных орбиталей возможно образование и σ-связи (перекрывание по оси химической связи), и π-связи (перекрывание по обе стороны от оси химической связи).
5) Молекулярная орбиталь, не участвующая в образовании химической связи, носит название несвязывающей. Ее энергия равна энергии исходной АО.
6)На одной молекулярной орбитали (как, впрочем, и атомной) возможно нахождение не более двух электронов.
7)Электроны занимают молекулярную орбиталь с наименьшей энергией (принцип наименьшей энергии).
8)Заполнение вырожденных (с одинаковой энергией) орбиталей происходит последовательно по одному электрону на каждую из них.
Применим метод МО ЛКАО и разберем строение молекулы водорода.
Мысленно перекроем две атомные орбитали, образовав две молекулярные, одна из которых (связывающая) обладает меньшей энергией (расположена ниже), а вторая (разрыхляющая) – большей энергией (расположена выше)

Рис. 8 Энергетическая диаграмма образования молекулы Н2
Метод МО ЛКАО позволяет наглядно объяснить образование ионов Н2+, что вызывает трудности в методе валентных связей. На σ-связывающую молекулярную орбиталь катиона Н2+переходит один электрон атома H с выигрышем энергии. Образуется устойчивое соединение с энергией связи 255кДж/моль. Кратность связи равна ½. Молекулярный ион парамагнитен. Молекула обычного водорода содержит уже два электрона с противоположными спинами на σcв1s-орбитали: Энергия связи в Н2 больше, чем в H2+  - 435 кДж/моль. В молекуле Н2 имеется одинарная связь, молекула диамагнитна.
- 435 кДж/моль. В молекуле Н2 имеется одинарная связь, молекула диамагнитна.

Рис. 9 Энергетическая диаграмма образования иона Н2+
Используя метод МО ЛКАО, рассмотрим возможность образования молекулы He2
В этом случае два электрона займут связывающую молекулярную орбиталь, а два других – разрыхляющую. Выигрыша в энергии такое заселение двух орбиталей электронами не принесет. Следовательно, молекулы He2 не существует.

Рис. 10 Энергетическая диаграмма, иллюстрирующая невозможность образования химической
связи между атомами He
Заполнение молекулярных орбиталей происходит при соблюдении принципа Паули и правила Хунда по мере увеличения их энергии в такой последовательности:
σ1s < σ*1s < σ2s < σ*2s < σ2pz < π2px = π2py < π*2px =π*2py < σ*2pz
Значения энергии σ2p и π2p близки и для некоторых молекул(В2,С2,N2) соотношение обратное приведённому: сначала π2p потом σ2p
Таблица 1 Энергия и порядок связи в молекулах элементов 1 периода
| Молекулы и молекулярные ионы | Электронная конфигурация | Энергия связи кДж/моль | Порядок связи |
| Н2+ | (σs)1 | 0,5 | |
| Н2 | (σs)2(σs*)1 | ||
| Н2- | (σs)2(σs*)1 | - | 0,5 |
| НеН | (σs)2(σs*)1 | - | 0,5 |
| Не2+ | (σs)2(σs*)1 | 0,5 | |
| Не2 | (σs)2(σs*)2 | - |
Согласно методу МО п орядок связи в молекуле определяется разностью между числом связывающих и разрыхляющих орбиталей, деленный на два. Порядок связи может быть равен нулю (молекула не существует), целому или дробному положительному числу. При нулевой кратности связи,как в случае Не2,молекула не образуется.
На рисунке 11 изображена энергетическая схема образования молекулярных орбиталей из атомных для двухатомных гомоядерных (одного и того же элемента) молекул элементов второго периода. Число связывающих и разрыхляющих электронов зависит от их числа в атомах исходных элементов.

Рис.11 Энергетическая диаграмма образования двухатомных молекул
элементов 2 периода
Образование молекул из атомов элементов II периода может быть записано следующим образом
(К – внутренние электронные слои):
Li 2 [KK(σs)2]
Be2 [KK(σs)2(σs*)2] молекула не обнаружена, как и молекула Не2
B2 [KK(σs)2(σs*)2 (πx)1(πy)1] молекула парамагнитна
C2 [KK(σs)2(σs*)2(πx)2(πy)2]
N2 [KK(σs)2(σs*)2(πx)2(πy)2(σz)2 ]
O2 [KK(σs)2(σs*)2(σz)2(πx)2(πy)2(πx)1(πy)1 ] молекула парамагнитна
F2 [KK(σs)2(σs*)2(σz)2(πx)2(πy)2(πx)2(πy)2 ]
Ne2 [KK(σs)2(σs*)2(σz)2 (πx)2(πy)2(πx)2(πy)2(σz*)2 ] молекула не обнаружена
Методом МО ЛКАО легко продемонстрировать парамагнитные свойства молекулы кислорода. С тем чтобы не загромождать рисунок, не будем рассматривать перекрывание 1 s -орбиталей атомов кислорода первого (внутреннего) электронного слоя. Учтем, что p -орбитали второго (внешнего) электронного слоя могут перекрываться двумя способами. Одна из них перекроется с аналогичной с образованием σ-связи.

|
| Рис.12 Перекрывание p-АО, направленных вдоль оси x σ-связи |
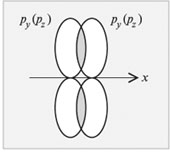
Две других p -АО перекроются по обе стороны от оси x с образованием двух π-связей.
|
| Рис.13 Перекрывание p-АО, направленных вдоль оси y (z), с образованием π-связи |
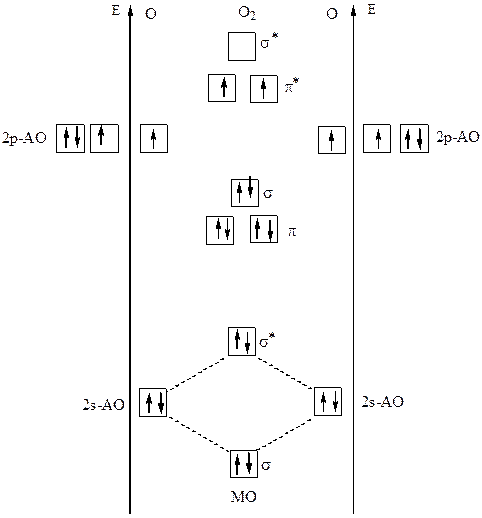
Рис. 14 Энергетическая диаграмма,иллюстрирующая с помощью метода МО ЛКАО
парамагнитные свойства молекулы O2
Энергии молекулярных орбиталей могут быть определены по данным спектров поглощения веществ в ультрафиолетовой области. Так, среди молекулярных орбиталей молекулы кислорода, образовавшихся в результате перекрывания p -АО, две π-связывающие вырожденные (с одинаковой энергией) орбитали обладают меньшей энергией, чем σ-связывающая, впрочем, как и π*-разрыхляющие орбитали обладают меньшей энергией в сравнении с σ*-разрыхляющей орбиталью.
В молекуле O2 два электрона с параллельными спинами оказались на двух вырожденных
(с одинаковой энергией) π*-разрыхляющих молекулярных орбиталях. Именно наличием неспаренных электронов и обусловлены парамагнитные свойства молекулы кислорода, которые станут заметными, если охладить кислород до жидкого состояния.
Так, электронная конфигурация молекул О2 описывается следующим образом:
О2 [КК(σs)2(σs*)2(σz)2(πx)2(πy)2(πx*)1(πy*)1]
Буквами КК показано, что четыре 1 s -электрона (два связывающих и два разрыхляющих) практически не оказывают влияния на химическую связь.
Поскольку три атома водорода имеют только три 1 s -орбитали, то суммарное число образованных молекулярных орбиталей будет равно шести (три связывающих и три разрыхляющих). Два электрона атома азота окажутся на несвязывающей молекулярной орбитали (неподеленная электронная пара).
Наилучшим способом квантовомеханической трактовки химической связи в настоящее время считается метод молекулярных орбиталей (МО). Однако он гораздо сложнее метода ВС и не столь нагляден, как последний.
Существование связывающих и разрыхляющих МО подтверждается физическими свойствами молекул. Метод МО позволяет предвидеть, что если при образовании молекулы из атомов электроны в молекуле попадают на связывающие орбитали, то потенциалы ионизации молекул должны быть больше, чем потенциалы ионизации атомов, а если электроны попадают на разрыхляющие орбитали, то наоборот. Так, потенциалы ионизации молекул водорода и азота (связывающие орбитали) – 1485 и 1500 кДж/моль соответственно – больше, чем потенциалы ионизации атомов водорода и азота – 1310 и 1390 кДж/моль, а потенциалы ионизации молекул кислорода и фтора (разрыхляющие орбитали) – 1170 и 1523 кДж/моль – меньше, чем у соответствующих атомов – 1310 и 1670 кДж/моль. При ионизации молекул прочность связи уменьшается, если электрон удаляется со связывающей орбитали (H2 и N2), и увеличивается, если электрон удаляется с разрыхляющей орбитали(О2 и F2).
Полярность связи
Между разными атомами чистая ковалентная связь может проявляться, если электроотрицательность (ЭО) атомов одинакова. Такие молекулы электросимметричны, т.е. «центры тяжести» положительных зарядов ядер и отрицательных зарядов электронов совпадают в одной точке, поэтому их называют неполярными.
Если соединяющиеся атомы обладают различной ЭО, то электронное облако, находящееся между ними, смещается из симметричного положения ближе к атому с большей ЭО:
Смещение электронного облака называется поляризацией. В результате односторонней поляризации центры тяжести положительных и отрицательных зарядов в молекуле не совпадают в одной точке, между ними возникает некоторое расстояние (l). Такие молекулы называются полярными или диполями, а связь между атомами в них называется полярной. Например, в молекуле HCl связующее электронное облако смещено в сторону более электроотрицательного атома хлора. Таким образом, атом водорода в хлороводороде поляризован положительно, а атом хлора отрицательно.
На атоме водорода возникает положительный заряд δ= +0,18, а атоме хлора - отрицательный δ=-018. следовательно связь в молекуле хлороводорода имеет на 18% ионный характер.
Полярная связь – разновидность ковалентной связи, претерпевшей незначительную одностороннюю поляризацию. Расстояние между «центрами тяжести» положительных и отрицательных зарядов в молекуле называется длиной диполя. Естественно, что чем больше поляризация, тем больше длина диполя и больше полярность молекул. Для оценки полярности молекул обычно пользуются постоянным дипольным моментом µ, представляющим собой произведение величины элементарного электрического заряда q на длину диполя (l), т.е. µ = q∙l. Дипольные моменты измеряют в кулонометрах.
Таблица 2 Электрический момент диполя µ некоторых молекул
| Молекула | µ∙1029 Кл∙м | Молекула | µ∙1029 Кл∙м |
| H2 | HF | 0,640 | |
| N2 | HCl | 0,347 | |
| CO | 0,033 | HBr | 0,263 |
| NO | 0,023 | HI | 0,127 |
Суммарный дипольный момент сложной молекулы можно считать равным векторной сумме дипольных моментов отдельных связей. Дипольный момент обычно принято считать направленным от положительного конца диполя к отрицательному. Результат сложеиия зависит от структуры молекулы. Дипольный моиент высокосимметричных молекул BeCl2, BF3, CCl4 равен нулю, хотя связи Be - Cl, B - F, C-Cl имеют сильно полярный характер. В угловой молекуле Н2О полярные связи О-Н расположены под углом 104,5о. Поэтому молекула оказывается полярной
(µ = 0,61∙10-29 Кл∙м)
При очень большой разности электроотрицательности у атомов имеет место явная односторонняя поляризация: электронное облако связи максимально смещается в сторону атома с наибольшей электроотрицательностью, атомы переходят в противоположно заряженные ионы и возникает ионная молекула. Ковалентная связь становится ионной. Электроасимметрия молекул возрастает, длина диполя увеличивается, дипольный момент возрастает.
Предсказать полярность связи можно с помощью относительной ЭО атомов. Чем больше разность относительных ЭО атомов, тем сильнее выражена полярность. Правильнее говорить о степени ионности связи, поскольку связи не бывают ионными на 100%. Даже в соединении CsF связь ионная только на 89%.
Если рассматривать соединения элементов какого-либо периода с одним и тем же элементом, то по мере передвижения от начала к концу периода преимущественно ионный характер связи сменяется на ковалентный. Например, у фторидов 2-го периода LiF, BeF2, CF4, NF3, OF2, F2 степень ионности связи от фторида лития постепенно ослабевает и заменяется типично ковалентной связью в молекуле фтора.
Электроотрицательность серы значительно меньше, чем ЭО кислорода. Поэтому полярность связи H –S в H2S меньше полярности связи Н–О в Н2О, а длина связи H–S (0,133 нм) больше, чем Н–О (0,56 нм) и угол между связями приближается к прямому. Для H2S он составляет 92о, а для H2Se – 91o.
По этим же причинам молекула аммиака имеет пирамидальное строение и угол между валентными связями H–N–H больше прямого (107,3о). При переходе от NH3 к PH3, AsH3 и SbH3 углы между связями составляют соответственно 93,3о; 91,8о и 91,3о.
Ионная связь
Не нашли, что искали? Воспользуйтесь поиском: