
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Корозія конструкційних матеріалів.
Коро́зія металів – процес хімічного руйнування металів і сплавів при їх взаємодії із зовнішнім середовищем: повітрям, водою, розчинами електролітів тощо. Розрізняють два види корозії: хімічну й електрохімічну.
Хімічна корозія відбувається в середовищах, які не проводять електричного струму. Вона обумовлюється дією на метали неелектролітів (спирту, бензину, мінеральних масел тощо) і сухих газів (кисню, оксидів азоту, хлору, хлороводню, сірководню та ін.) при високій температурі (так звана газова корозія).
У результаті взаємодії металів із зовнішнім середовищем їхня поверхня вкривається тонким шаром (плівкою) різних хімічних сполук (продуктів корозії): оксидів, хлоридів, сульфідів і т. д. Інколи цей шар настільки щільний, що крізь нього не може проникати агресивне середовище. В таких випадках із часом швидкість корозії зменшується, а то й зовсім припиняється. Наприклад, алюміній в атмосфері повітря кородує значно повільніше за залізо, хоч за своїми хімічними властивостями він активніший за нього. Це пояснюється тим, що поверхня алюмінію вкривається суцільною, досить щільною і міцною оксидною плівкою, яка ізолює метал від доступу кисню, а оксидна плівка заліза, навпаки, є крихкою і ламкою, містить багато пор і тріщин, через що кисень повітря крізь неї легко проникає до поверхні заліза, і тим обумовлюється безперервне його руйнування.
Електрохімічна корозія більш поширена й завдає значно більшої шкоди, ніж хімічна. Вона виникає при контакті двох металів у середовищі водних розчинів електролітів. На відміну від хімічної, електрохімічна корозія супроводжується переміщенням валентних електронів з одної ділянки металу на іншу, тобто виникненням місцевих електричних струмів унаслідок утворення на кородуючій поверхні так званих гальванічних пар.
Для кращого розуміння механізму електрохімічної корозії розглянемо докладніше процес розчинення металу в розчині електроліту з виділенням водню, наприклад розчинення цинкової пластинки в розведеній сульфатній кислоті без контакту й у контакті з мідною пластинкою (рис. 6.2).
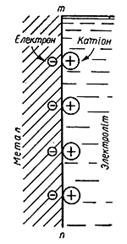
Рис. 6.2. Подвійний електричний шар на границі метал – електроліт
При зануренні цинкової пластинки в кислоту атоми цинку з її поверхні поступово переходять у розчин у вигляді іонів Zn2+, а їхні валентні електрони залишаються на поверхні металу. Унаслідок цього на границі метал – електроліт утворюється подвійний електричний шар. Внутрішню обкладку цього шару утворюють негативні заряди надлишкових електронів (позначених знаком –), а зовнішню обкладку – позитивні заряди іонів цинку (позначених знаком +). Внаслідок взаємного притягання між протилежними зарядами іони цинку, що переходять у розчин, містяться поблизу поверхні металу. Подальший процес розчинення цинку стає можливим лише завдяки тому, що іони водню підходять до поверхні цинку й приєднують надлишкові електрони.
Біокорозія – корозія металів, спричинювана мікроорганізмами або продуктами їхньої життєдіяльності.
При цьому іони цинку перестають утримуватись у подвійному електричному шарі негативними зарядами й вільно дифундують у глибину розчину, а на їхнє місце з поверхні металу переходять нові іони цинку й т. д. Таким чином, приєднання надлишкових електронів із поверхні металу іонами водню електроліту забезпечує безперервний перехід іонів цинку в розчин, тобто його розчинення (кородування).
Із цього виходить, що процес розчинення цинку в кислоті складається з двох паралельних процесів: з віддачі атомами цинку валентних електронів (окиснення цинку) і переходу іонів цинку в розчин:
(Метал) 2e ← Zn0 → Zn2+ (розчин)
і з приєднання надлишкових електронів іонами водню (відновлення іонів водню) і виділення вільного водню:
(Метал) 2е + 2Н+ → 2Н° → Н2 ↑
Обидва ці процеси відбуваються на поверхні того самого металу – на цинковій пластинці. Але за певних умовах їх можна просторово роз’єднати. Так, коли поряд із цинковою пластинкою занурити в розчин мідну й обидві пластинки з’єднати металевим провідником, то перший процес (розчинення цинку) буде відбуватися на цинковій пластинці, а другий (відновлення іонів водню) – на мідній.
Мідь, як відомо, з розведеною сульфатною кислотою не взаємодіє. Тому іони міді не переходять у розчин і на її поверхні не буде надлишків електронів. Але коли обидві пластинки з’єднати мідною дротиною, то концентрація надлишкових електронів (цинкової пластинки) почне вирівнюватись на обох пластинках і електрони з цинкової пластинки почнуть переміщатися на мідну. Якщо до системи включити гальванометр, то він покаже наявність електричного струму. Однак концентрація електронів на обох пластинках не може бути однаковою. Це пояснюється тим, що іони водню легше розряджаються (приєднують електрони) на поверхні міді, ніж на поверхні цинку. Через це процес відновлення іонів водню і виділення вільного водню буде відбуватися практично лише на мідній пластинці, а на цинковій майже зовсім припиниться. Але швидкість розчинення цинку при цьому значно збільшиться, оскільки надлишкові електрони з поверхні цинку будуть швидко переміщатися на мідну пластинку й там приєднуватися іонами водню.
Приклад розчинення цинку, що перебуває в контакті з міддю, у розчині сульфатної кислоти є прикладом утворення і роботи гальванічних пар, які лежать в основі електрохімічної корозії. Гальванічні пари можна утворювати з будь-яких двох металів, які контактують між собою і занурені в розчин електроліту. При цьому швидкість кородування активнішого металу значно збільшується, а менш активний метал зовсім не кородує. На ньому відбувається лише відновлення іонів водню тими електронами, що прибувають із поверхні активнішого металу.
Електрохімічна корозія металів виникає не тільки в присутності сильних, а й слабких електролітів і навіть тонкого шару вологи, якою вкриваються металеві конструкції в атмосфері повітря. Будучи дуже слабким електролітом, вода теж дисоціює, утворюючи іони Н+ і ОН-, хоч і в незначній кількості. Але при розчиненні в ній різних солей, що містяться в повітрі у вигляді пилу й газів – CO2, SO2 та ін., концентрація різних іонів, у тому числі й іонів водню, збільшується і стає достатньою для виникнення і перебігу електрохімічної корозії.
Як приклад електрохімічної корозії в присутності вологи й повітря розглянемо процес кородування залізної конструкції з мідними заклепками (рис. 6.3). Коли така конструкція вкривається шаром вологи (розчином електроліту), то залізні й мідні ділянки її поверхні утворюють гальванічні пари. При цьому атоми заліза як більш активного металу переходять у розчин у вигляді двовалентних іонів Fe2+, а втрачені ними валентні електрони переміщаються на мідь і там приєднуються катіонами водню, відновлюючи їх до вільного водню. Процес кородування заліза в контакті з міддю схематично можна зобразити такими рівняннями:

Рис. 6.3. Схема корозії заліза в контакті з міддю
1. Дисоціація води: 
2. Втрата атомами заліза валентних електронів і перехід іонів у розчин: (Метал) 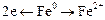 (розчин).
(розчин).
3. Відновлення катіонів водню (на поверхні міді) і виділення вільного водню: 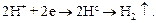
4. Утворення дигідроксиду заліза: 
5. Окиснення двовалентного заліза до тривалентного розчиненим киснем повітря: 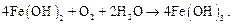
6. Часткова втрата води тригідроксидом заліза й перетворення його на гідроксид – оксид заліза:
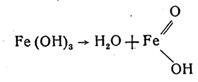
У результаті цих реакцій залізо вкривається шаром іржі, яка складається головним чином із FeO(OH), а також із гідроксидів заліза Fe(OH)2 і Fe(OH)3.
Гальванічні пари на кородуючій поверхні можуть утворюватись не лише при контакті двох металів із великими поверхнями, а й при контакті основного металу з нерозчинними в ньому домішками інших металів, які завжди містяться в технічних металах. У таких випадках на кородуючій поверхні металу утворюється безліч невеликих за розмірами так званих мікрогальванічних пар, роботою яких обумовлюється електрохімічне кородування основного металу. Як при контакті двох різних металів (утворенні макрогальванічних пар), так і за наявності в основному металі нерозчинних домішок інших металів (утворенні мікрогальванічних пар) потік електронів (електричного струму) спрямований від більш активного металу до менш активного. Більш активний метал кородує (руйнується), а менш активний не кородує. На ньому лише відновлюються іони водню тими електронами, що прибувають від атомів активнішого металу. Швидкість електрохімічної корозії тим більша, чим більше утворюється на кородуючій поверхні гальванічних пар, тобто чим більше є контактів основного металу з іншими менш активними металами або чим більше він забруднений домішками менш активних металів. Чим чистіший метал, тим менше він піддається корозії, а дуже чисті метали майже зовсім не кородують.
Швидкість електрохімічної корозії залежить також від різниці активності металів, що утворюють гальванічні пари. Чим більш віддалені ці метали один від одного в електрохімічному ряді напруг, тим більша швидкість корозії. На швидкість корозії впливають також електроліт і температура. Чим сильніший електроліт, тобто чим більше міститься в ньому іонів, зокрема іонів водню, і чим вища температура, тим більша швидкість електрохімічної корозії.
Не нашли, что искали? Воспользуйтесь поиском: